Reakční rychlost
Studiem reakční rychlosti se zabývá chemická kinetika.
Aby mohly spolu dvě či více látek reagovat, musí dojít ke srážce jejich molekul. Pravděpodobnost srážky se zvyšuje s rostoucí teplotou, tlakem a koncentrací látek.
Reakční rychlost (v) můžeme definovat jako rychlost úbytku reaktantů či rychlost přírůstku produktů, tedy např. pro reakci a A + b B → c C + d D:
Zabývejme se podrobněji vztahem mezi rychlostí reakce a koncentrací reaktantů. Uvažujme jednoduchou reakci X → Y. Její rychlost bude úměrná [X] podle rovnice:
| (15) |
kde k je rychlostní konstanta.
V některých případech může být rychlost úměrná [X]2, může na [X] záviset složitěji, nebo naopak nemusí být na [X] závislá vůbec vůbec (v takovém případě probíhá reakce konstantní rychlostí). Přesný vztah mezi reakční rychlostí a koncentrací reaktantů je empirický fakt a – zejména bereme-li v úvahu reakce se složitějšími reakčními mechanismy – nedá se odvodit jen ze stechiometrie pozorované přeměny.
Chemici definují kinetický řád reakce podle počtu členů, jejichž koncentrace ovlivňují rychlost. Pokud rychlost na koncentraci nezávisí, a tedy platí rovnice v = k, hovoříme o řádu nultém. Je-li rychlost přímo úměrná koncentraci jednoho z reaktantů, jedná se o kinetiku prvního řádu (jako v případě výše uvedené reakce (15)). Jestliže je rychlost ovlivněna koncentrací dvou reaktantů nebo se jedná o exponenciální vztah jednoho reaktantu (v = k · [X] · [Y] nebo v = k · [X]2), hovoříme o kinetice druhého řádu atd.
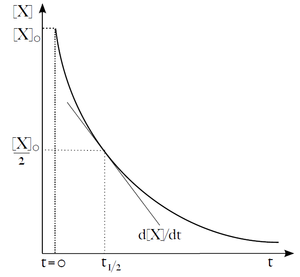
Někdy chceme předpovědět, jaké množství reaktantu X zůstane nezreagováno po čase t od začátku reakce, nebo jak dlouho potrvá, než [X] klesne na polovinu. Při reakcích nultého řádu je výpočet jednoduchý, ale pro řády vyšší se komplikuje.
Pro reakci prvního řádu platí:
| (16) |
Integrací rovnice (16) dostáváme:
| (17) |
Řešením pro počátek reakce, tj. pro t = 0 (přičemž výchozí koncentraci látky X v tomto čase označíme jako [X]0) dostáváme
| (18) |
| (19) |
Tato rovnice popisuje exponenciální pokles koncentrace X v čase. Užitečným parametrem exponenciálního rozkladu je čas potřebný na snížení počáteční koncentrace (či množství) látky X na polovinu. Nazývá se poločas (t1/2). Z rovnice (19) můžeme poločas vyjádřit jako:

![{\displaystyle v=-{\frac {1}{a}}\cdot {\frac {d[A]}{dt}}=-{\frac {1}{b}}\cdot {\frac {d[B]}{dt}}={\frac {1}{c}}\cdot {\frac {d[C]}{dt}}={\frac {1}{d}}\cdot {\frac {d[D]}{dt}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4707b4595695ab5e07bc99342d80e763feb418c0)
![{\displaystyle v=-{\frac {d[X]}{dt}}=k\cdot [X]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/455ad6de0a9c5b0eecd84b2bb4229257516bfd65)
![{\displaystyle -{\frac {d[X]}{dt}}=k\cdot [X]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e901a271febbaa8531f29f808e1bd2b66568ed1b)
![{\displaystyle -{\frac {1}{[X]}}\cdot {\frac {d[X]}{dt}}=k\cdot [X]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c9b87da63afed0a70224765a4433d055501ccf30)
![{\displaystyle -\int {{\frac {1}{[X]}}\cdot {\frac {d[X]}{dt}}}=\int {k\cdot [X]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cdb831679df28930d5c9a2e0d56941f14273c36f)
![{\displaystyle -ln[X]=k\cdot t+c}](https://wikimedia.org/api/rest_v1/media/math/render/svg/30dcc458e5e2aa7d2d75f16b70823b88e89aa6d8)
![{\displaystyle c=-ln[X]_{0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f15993399d0ef0333e597a54eb50e19e1ebab64b)
![{\displaystyle -ln[X]=k\cdot t-ln[X]_{0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b3a57b5821357a65c5d8ffbd86e6c34fa4be7416)
![{\displaystyle -ln[X]+ln[X]_{0}=k\cdot t}](https://wikimedia.org/api/rest_v1/media/math/render/svg/473243524faadf0edf37c54e2d6612c017b76bf0)
![{\displaystyle -ln{\frac {[X]}{[X]_{0}}}=k\cdot t}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f2de7a0bbb3b34af731e0e74ec0cb53cea459123)
![{\displaystyle {\frac {[X]}{[X]_{0}}}=e^{-k\cdot t}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1077126a021a629dfbe6e98dccd3132b47f5713a)
![{\displaystyle [X]=[X]_{0}\cdot e^{-k\cdot t}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6bf69f402892c84545b5a0aef7196819cbe28fd5)