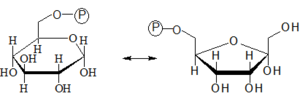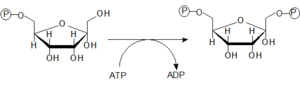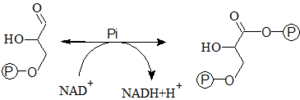Odbourávání a syntéza glukózy
Náplň podkapitoly
- Úvod do odbourávání a syntézy glukózy.
- Glykolýza.
- Glukoneogeneze.
Úvod do odbourávání a syntézy glukózy
Sacharidy, jedna z hlavních živin heterotrofních organismů, se nacházejí v každé buňce našeho těla, kde plní řadu funkcí – zdroj energie pro buňky, zdroj uhlíkových atomů pro syntézu látek, rezervní forma chemické energie (glykogen) či strukturní funkce (proteoglykany).
Glukóza
Glukóza (Glc) je univerzální energetický substrát – oxidací jednoho gramu glukózy získáme přibližně 17 kJ, tj. 4 kcal. Značný význam má fakt, že naše buňky z ní dovedou získávat energii i za nepřítomnosti O2. To glukózu odlišuje od ostatních živin. Některé buňky, např. erytrocyty či buňky CNS, na glukóze dokonce striktně závisí. Pyruvátdehydrogenázová reakce (PDH) je nevratná, a proto nelze syntetizovat glukózu z mastných kyselin. Nadbytek sacharidů naopak dokáže naše tělo přeměnit skrze acetyl-CoA na mastné kyseliny a následně na triacylglyceroly (TAG).
Glykémie označuje koncentraci glukózy v krvi. Její normální hladina nalačno činí 3,3–5,6 mmol/l, po jídle však může přechodně vystoupit až na 7,0 mmol/l. Za fyziologických okolností se glukóza nevylučuje močí. Pokud glykémie překročí hodnotu 10 mmol/l (tzv. ledvinný prah pro glukózu), objeví se glukóza v definitivní moči – hovoříme pak o glykosurii.
Glukóza se v potravě vyskytuje buď volná, nebo jako součást disacharidů či polysacharidů. Z trávicího traktu se do krve vstřebává pouze volná glukóza.
Zdroje krevní glukózy
- Sacharidy z potravy (trávení sacharidů v GIT), případně přeměna jiných živin z potravy na glukózu.
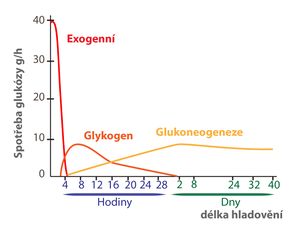
- Rozklad jaterního glykogenu – využívá se mezi jídly. Zásoba jaterního glykogenu vystačí asi na 24 hodin.
- Glukoneogeneze z C3 a C4 látek (laktát, glycerol, většina aminokyselin) je zdrojem glukózy při dlouhodobém lačnění nebo při patologických podmínkách. V době dlouhodobého hladovění činí podíl energie čerpané z glukózy na celkové spotřebě organismu pouze 20 %, větší část energie se získává oxidací lipidů.
Příjemci krevní glukózy
- Spotřeba tkáněmi závislými na glukóze, jako je mozek, erytrocyty – nezávislé na inzulinu.
- Spotřeba tkáněmi, které nejsou závislé na glukóze, a mohou tedy využívat i jiné energetické substráty, např. kosterní svaly – závislé na inzulinu.
- Syntéza glykogenu v játrech, svalech a dalších tkáních.
- Přebytek glukózy se přemění na mastné kyseliny a TAG – skladování zejména v tukové tkáni.
- Tvorba mnoha významných látek (ostatní monosacharidy, deriváty monosacharidů apod.).
Sacharidy jsou metabolizovány ve formě fosforečných esterů. Klíčová látka v metabolismu sacharidů, glukóza-6-fosfát (Glc-6-P), představuje spojnici mnoha metabolických drah: glykolýzy, glukoneogeneze, pentózového cyklu, glykogeneze a glykogenolýzy. Zároveň udržuje glukózu v buňkách, neboť tento derivát neprochází buněčnou membránou. Fosforylací glukózy je stále udržován koncentrační gradient glukózy mezi extracelulárním a intracelulárním prostorem, což usnadňuje další vstup glukózy do buňky.
Glykolýzu používají vyšší organismy jako hlavní cestu odbourávání sacharidů, pentózový cyklus pak jako cestu doplňkovou.
Mechanismus transportu glukózy přes buněčnou membránu
Glukóza může být transportována přes membránu dvěma mechanismy:
- usnadněnou difuzí pomocí GLUT přenašečů;
- sekundárně aktivním transportem prostřednictvím SGLT transportérů.
V buněčných membránách se vyskytuje celá řada glukózových transportérů fungujících na principu facilitované difuze. Jedná se o pasivní proces, v jehož průběhu jsou molekuly glukózy převáděny po svém koncentračním gradientu za pomoci přenašeče GLUT 1-7 (GLUcose Transporter). Z nich pouze GLUT 4 závisí na hladině inzulinu. Inzulin po navázání na svůj receptor zvyšuje počet GLUT 4 transportérů v membráně příslušných buněk.
Zde uvádíme základní přehled GLUT transportérů:
- GLUT 1 a 3 – slouží k udržení bazálního vychytávání glukózy tkáněmi, jejichž metabolismus je na glukóze závislý (mozek, erytrocyty, ale také ledviny a placenta).
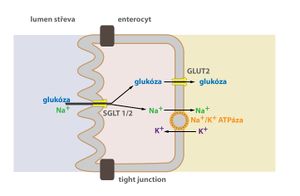
- GLUT 2 – lokalizovaný na membráně β-buněk pankreatu a hepatocytů, umožňuje také přestup glukózy z resorpčních epitelů (proximální tubulus ledvin, enterocyty střeva) do krve.
- GLUT 4 – je transportérem glukózy v tzv. inzulin-dependentních tkáních – kosterní sval, myokard a tuková tkáň. Jeho vystavení na membráně totiž podmiňuje přítomnost vyšších hladin inzulinu v krvi – přenašeče jsou připraveny ve vezikulech a po vazbě inzulinu na receptor nastává fúze vezikul s buněčnou membránou. K tomu dochází zejména po jídle, kdy zmíněné tkáně zodpovídají za metabolismus až 80 % glukózy z krve. V období mezi jídly ji naopak neresorbují a šetří ji pro tkáně na ní závislé.
V enterocytech a v buňkách proximálního tubulu ledvin se glukóza vstřebává z lumen aktivním transportem. Přenos glukózy zajišťuje kotransport s Na+. Molekuly glukózy jdou proti svému koncentračnímu gradientu do buňky. Energii poskytnou ionty Na+, které procházejí do buňky po svém koncentračním gradientu. Tento přenos umožňují tzv. SGLT-1 a 2 (Sodium-GLucose Transporter). Ke zpětnému transportu Na+ do ECT se spotřebovává ATP – Na+/K+-ATPáza. Proto hovoříme o sekundárně aktivním transportu.
Glykolýza
Embden-Meyerhof-Parnasova dráha
Glykolýza (neboli Embden-Meyerhof-Parnasova dráha) je základní metabolický děj probíhající v cytoplazmě všech buněk lidského těla. Řadí se mezi katabolické dráhy. Glykolýzou vznikají z jedné molekuly glukózy dvě tříuhlíkaté molekuly – pyruvát (Pyr) či laktát (Lac). Glykolýza plní mnoho funkcí, například zisk energie či tvorbu acetyl-CoA jako substrátu pro syntézu lipidů.
Glykolýza probíhá jak za aerobních, tak i za anaerobních podmínek. Za aerobních podmínek se vytvářejí dvě molekuly pyruvátu, dvě molekuly ATP a dvě molekuly NADH. Za anaerobních podmínek podléhá pyruvát další reakci, která regeneruje kofaktor NAD+ – produktem je pak laktát.
Reakce glykolýzy
Celou glykolýzu můžeme souhrnně zapsat jako rovnici:
- Glukóza + 2 NAD+ + 2 ADP + 2 Pi → 2 pyruvát + 2 NADH + 2 ATP + 2 H2O
Glykolýza se dělí do několika fází:
- Investice energie a současná aktivace molekul glukózy.
- Štěpení hexózy na dvě triózy.
- Oxidace trióz a současný zisk energie.
- Přeměna pyruvátu na laktát (za anaerobních podmínek).
- V následujícím přehledu popíšeme její jednotlivé reakce
- 1. Fosforylace glukózy
- Po vstupu molekul glukózy do buněk dochází k jejich okamžité fosforylaci. Tato reakce přeměňuje neutrální molekulu glukózy na anion. Takto modifikovaná glukóza může být dále metabolizována a současně již neprochází buněčnou membránou. Zachycuje se tedy v cytosolu, kde je dále metabolizována.
- Glukóza + ATP → Glc-6-P + ADP
- Kromě jedné makroergní vazby molekuly ATP vyžaduje reakce i enzymovou katalýzu zprostředkovanou jedním ze dvou izoenzymů – hexokinázou či glukokinázou.
- Glukokináza (neboli hexokináza typu IV) je lokalizována pouze v hepatocytech a v β-buňkách pankreatu, zatímco hexokináza je ve všech tkáních. Kromě lokalizace se liší i ve svých fyzikálně-chemických vlastnostech. Glukokináza má vysokou hodnotu KM (10 mmol/l), a proto je aktivována až při vyšších koncentracích glukózy. Uplatňuje se převážně po jídle, kdy je koncentrace glukózy v portální krvi vysoká a je zapotřebí ji vychytávat játry (např. pro syntézu glykogenu). β-buňky pankreatu zároveň reagují na vyšší hladiny glykémie zvýšením sekrece inzulinu.
- Hexokináza je za fyziologických podmínek vždy téměř plně aktivní, neboť její KM je pouhých 0,1 mmol/l (srovnej s fyziologickým rozsahem glykémie 3,3–5,6 mmol/l). Její aktivita je tedy regulována jiným mechanismem a tím je inhibice svým vlastním produktem – Glc-6-P. Zjednodušeně se tedy dá říci, že hexokináza produkuje tolik Glc-6-P, kolik je buňka schopna utilizovat ve svých drahách. Jakmile se začne Glc-6-P hromadit, dojde k inhibici hexokinázy. Kromě fosforylace glukózy umožňuje hexokináza i fosforylaci fruktózy.
- 2. Izomerizace Glc-6-P na Fru-6-P
- Izomerizace Glc-6-P na Fru-6-P je reverzibilní reakce probíhající za katalýzy hexosafosfátizomerázou.
- 3. Fosforylace Fru-6-P za spotřeby ATP na Fru-1,6-bisP
- Fosforylaci Fru-6-P na Fru-1,6-bisP katalyzuje enzym 6-fosfofrukto-1-kináza. Jedná se o klíčový allosterický regulační enzym glykolýzy.
- V průběhu dosavadních tří kroků došlo k investici dvou molekul ATP na jednu molekulu glukózy.
- 4. Aldolové štěpení Fru-1,6-bisP na dvě fosforylované triózy
- Fru-1,6-bisP se následně štěpí na dvě fosforylované triózy – glyceraldehyd-3-P (Gra-3-P, aldóza) a dihydroxyaceton-3-P (DHA-3-P, ketóza). Katalýzu zajišťuje aldoláza spadající do třídy lyáz. Rozlišujeme její dva izoenzymy – aldolázu A a B.
- 5. Izomerace trióz
- Glyceraldehyd-3-P a dihydroxyaceton-3-P se mohou přeměnit jeden v druhý pomocí enzymu triózafosfátizomerázy. Této reakci se přikládá velký význam, protože do další reakce glykolýzy se zapojuje jen glyceraldehyd-3-P a tato izomerace kontinuálně doplňuje jeho cytosolický pool.
- 6. Oxidace glyceraldehyd-3-P na 1,3-bisfosfoglycerát
- Tato reakce je jedinou oxidační reakcí v celé glykolýze. Oxidaci katalyzuje glyceraldehyd-3-fosfátdehydrogenáza. Reakcí vzniká 1,3-bisfosfoglycerát (energeticky bohatá sloučenina) a redukovaný kofaktor – NADH+H+. Reakce je exergonní – na oxidací nově vzniklou skupinu COO– se naváže Pi makroergní anhydridovou vazbou.
- 7. Přeměna 1,3-bisfosfoglycerátu na 3-fosfoglycerát
- 1,3-bisfosfoglycerát je hydrolyzován na 3-fosfoglycerát pomocí fosfoglycerátkinázy. Zároveň dojde k substrátové fosforylaci (fosforylace na substrátové úrovni) – z ADP se tvoří ATP.
- 8. Izomerace 3-fosfoglycerátu na 2-fosfoglycerát
- Izomeraci katalyzuje fosfoglycerátmutáza.
- 9. Dehydratace 2-fosfoglycerátu na fosfoenolpyruvát (PEP)
- Dehydrataci 2-fosfoglycerátu katalyzuje enzym enoláza. Reakce vede ke vzniku makroergní sloučeniny fosfoenolpyruvátu, který obsahuje esterově vázanou fosfátovou skupinu.
- 10. Přeměna fosfoenolpyruvátu na pyruvát
- Nejdříve probíhá odštěpení Pi, poté se nestabilní enol-pyruvát izomerizuje na stabilnější keto-pyruvát. Během této přeměny se uvolňuje velké množství volné energie. Tato reakce je tedy silně exergonická a prakticky nevratná. Uvolněná energie se využije k syntéze ATP z ADP – substrátová fosforylace.
- Reakci katalyzuje regulační enzym pyruvátkináza.
Během 4.–10. reakce se vytvořily dvě molekuly ATP na jeden tříuhlíkatý fragment (Pyr). Energetická bilance celé glykolýzy je tedy +2 moly ATP na 1 mol glukózy (−2 ATP spotřebováno, +4 ATP vytvořeno).
Metabolické osudy pyruvátu
Pyruvát je větvícím bodem glykolýzy. Osud pyruvátu závisí na oxidačním stavu buňky – NADH musí být reoxidováno na NAD+.
Za aerobních podmínek se pyruvát transportuje do matrix mitochondrie, kde se prostřednictvím pyruvátdehydrogenázové reakce mění na acetyl-CoA, který se může zapojit například do Krebsova cyklu. Redukovaný kofaktor NADH nemůže jednoduše přestoupit do matrix mitochondrie, kde by se měl zapojit do procesů v dýchacím řetězci, protože mitochondriální membrána je pro něj nepropustná. Proto se využívá k redukci některých látek – např. cytoplazmatického oxalacetátu na malát či dihydroxyaceton-P na glycerol-3-P. Vzniklé produkty již vnitřní mitochondriální membránou procházejí a dopraví tak redukční ekvivalenty do mitochondrie. Hovoříme o tzv. člunkovém mechanismu či jednoduše o čluncích. Pro přestup NADH existují v buňce dva různé člunky (anglicky shuttle) – glycerol-fosfátový a malát-aspartátový. V mitochondrii proběhnou výše uvedené reakce opačným směrem:
- Malát + NAD+ → oxalacetát + NADH+H+
- Glycerol-3-P + FAD → dihydroxyaceton-P + FADH2
Získané redukované kofaktory následně mohou vstoupit do mitochondriálního dýchacího řetězce, kde jsou regenerovány – souběžně vzniká aerobní fosforylací ATP. Návrat oxalacetátu (OAA) zpět do cytosolu není přímý. Vyžaduje nejdříve transaminaci na aspartát, kterou katalyzuje aspartátaminotransferáza (AST). V cytosolu proběhne opačná reakce – vzniká OAA.
Za anaerobních podmínek (např. intenzivně pracující sval s nedostatečnou dodávkou kyslíku) či v erytrocytech se pyruvát přeměňuje na laktát, který je následně uvolněn z buňky do krevního oběhu. Zároveň dochází k regeneraci NAD+. Reakci katalyzuje enzym laktátdehydrogenáza (LDH):
- Pyruvát + NADH + H+ → laktát + NAD+
Touto reakcí vytvořené NAD+ je koenzymem pro glyceraldehyd-3-fosfátdehydrogenázu, bez níž by se glykolýza zastavila. Vznikající laktát se jednak může zapojit do Coriho cyklu, jednak může být oxidován v tkáních s aerobním metabolismem (srdce, játra) na CO2 a H2O. Kumulace laktátu podmiňuje pokles pH, který způsobí svalovou bolest a únavu.
Na tomto místě je třeba připomenout, že aerobní glykolýza produkuje mnohem více ATP na 1 mol glukózy než anaerobní glykolýza.
2,3-BPG shunt
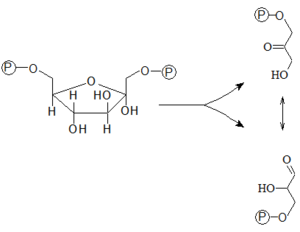
V erytrocytech hraje významnou roli odbočka glykolýzy nazývaná 2,3-BPG shunt. 1,3-bisfosfoglycerát se při ní přeměňuje na 2,3-bisfosfoglycerát. Tento meziprodukt již neobsahuje makroergicky vázaný fosfát, a při jeho další přeměně na 3-fosfoglycerát se tedy nesyntetizuje ATP – uvolní se jen anorganický fosfát. Erytrocyt tak při tomto průběhu glykolýzy získá méně ATP. Význam odbočky ale spočívá v tom, že 2,3-bisfosfoglycerát snižuje afinitu hemoglobinu ke kyslíku, tj. podílí se na regulaci transportu kyslíku na hemoglobinu.
Regulace glykolýzy
Regulačními body v glykolýze jsou tři enzymy:
- 6-fosfofrukto-1-kináza;
- pyruvátkináza;
- hexokináza.
- Tyto enzymy katalyzují nevratné exergonní reakce.
6-fosfofrukto-1-kináza (PFK-1)
Fosfofruktokináza, allosterický enzym regulovaný několika aktivátory a inhibitory, je hlavním regulačním bodem glykolýzy:
- Zvýšení poměru ATP / AMP vede k inhibici glykolýzy
- Glykolýza je děj směřující ke tvorbě ATP.
- ATP je substrátem a současně i allosterickým inhibitorem tohoto enzymu. AMP se oproti tomu chová jako aktivátor enzymu. Při nadbytku ATP se tedy zastaví další spotřeba glukózy jako živiny.
- Citrát inhibuje glykolýzu
- Pokud jsou oxidovány mastné kyseliny, vzniklý acetyl-CoA inhibuje PDH.
- Vznikající pyruvát směřuje do karboxylace na oxalacetát. Je-li současně dostatek acetyl-CoA i oxalacetátu, syntetizuje se citrát, který se hromadí před enzymem isocitrátdehydrogenázou. Citrát uniká do cytoplazmy, kde blokuje regulační enzym glykolýzy. Signalizuje totiž, že v mitochondrii je dostatek substrátů Krebsova cyklu, a tudíž není zapotřebí tvořit další.
- Fruktóza-2,6-bisfosfát (Fru-2,6-P)
- Fruktóza-2,6-bisfosfát, aktivátor glykolýzy, funguje jako prodloužená ruka inzulinu – jeho koncentrace se zvyšuje, pokud je poměr inzulin / glukagon zvýšený. Vzniká z fruktóza-6-P reakcí katalyzovanou 6-fosfofruktokinázou-2 (PFK-2).
- Glykolýzu aktivuje inzulin a inhibují ji kontraregulační hormony
- Vzestup poměru inzulin / glukagon snižuje intracelulární koncentraci cAMP; tím nastává převaha defosforylačních dějů. Pokles poměru a působení dalších kontraregulačních hormonů vyvolá naopak vzestup koncentrace cAMP – převažují fosforylační děje. 6-fosfofrukto-1-kináza je aktivní v defosforylované formě.
- Inhibice kyselým pH
- 6-fosfofrukto-1-kináza je inhibována protony. Jak pyruvát, tak laktát jsou poměrně silné kyseliny a jejich významná akumulace by mohla ohrozit buňku. Proto jejich zvýšené koncentrace vedou skrze protony k inhibici regulačního enzymu.
Zbylé enzymy mají menší význam, proto je popíšeme jen velmi stručně. Jak jsme již uvedli, hexokinázu jednak inhibuje její produkt – Glc-6-P, jednak ji aktivuje inzulin. Pyruvátkinázu reguluje kovalentní modifikace pod vlivem poměru inzulin / glukagon.
Klinické korelace
Mezi poměrně časté enzymatické defekty patří vrozený deficit pyruvátkinázy. Postiženy jsou převážně erytrocyty, v nichž se tvoří méně ATP. Z toho vyplývá jejich nižší schopnost udržet integritu své membrány (aktivní membránové transporty) a svůj tvar. Důsledkem je jejich zvýšený rozpad – rozvíjí se hemolytická anémie. Při nedostatečném okysličování tkání (hypoxii) se ve zvýšené míře tvoří laktát, který jako poměrně silná kyselina způsobuje okyselení těla – tomuto poklesu pH se říká laktátová acidóza.
Glukoneogeneze
Tvorba glukózy
Glukoneogeneze je proces tvorby molekul glukózy z látek nesacharidové povahy. Prekurzory jsou hlavně tří- a čtyřuhlíkaté látky – např. laktát, pyruvát, glycerol, alanin, glycin a jiné glukogenní aminokyseliny či propionát (hlavně u přežvýkavců). Glukoneogeneze je lokalizována jak v matrix mitochondrie, tak i v cytosolu, a to převážně v jaterních buňkách, tubulárních buňkách ledvin a v enterocytech. Díky glukoneogenezi dovedeme přežít i delší hladovění, protože zásoby glykogenu jsou vyčerpány přibližně během 24 hodin hladovění. K její aktivaci ale dochází již ráno po nočním hladovění.
Proces glukoneogeneze by mohl probíhat pouhým obrácením glykolýzy. Některé reakce glykolýzy jsou ale ireverzibilní a v glukoneogenezi je třeba je obejít s použitím odlišných enzymů. Hovoříme o tzv. bypassech 1, 2 a 3. Tři nevratné reakce v glykolýze katalyzují tři kinázy: pyruvátkináza, 6-fosfofrukto-1-kináza a hexokináza/glukokináza.
Reakce glukoneogeneze
V následujícím přehledu popíšeme jednotlivé reakce glukoneogeneze:
- 1. Bypass 1 – přeměna pyruvátu na fosfoenolpyruvát
- Prvním krokem je transport pyruvátu do matrix mitochondrie. Následuje jeho karboxylace na oxalacetát katalyzovaná pyruvátkarboxylázou za souběžné spotřeby ATP (kofaktorem je karboxybiotin). Oxalacetát se poté transportuje z mitochondrie do cytosolu (transaminace na Asp či redukce na malát), kde ho enzym fosfoenolpyruvátkarboxykináza přeměňuje na fosfoenolpyruvát (spotřebovává se GTP).
- 2. Reakce 3–8 jsou v podstatě obrácenou formou glykolýzy a odehrávají se v cytosolu
- 3. Bypass 2 – přeměna Fru-1,6-bisP na Fru-6-P
- Fruktóza-1,6-bisfosfatáza hydrolyzuje Fru-1,6-bisP na Fru-6-P. Tato reakce představuje klíčový regulační krok glukoneogeneze.
- 4. Fru-6-P se izomerizuje na Glc-6-P
- 5. Bypass 3 – přeměna Glc-6-P na volnou glukózu
- Glukóza-6-fosfatáza hydrolyzuje Glc-6-P na volnou glukózu – katalyzuje tedy odštěpení fosfátu. Tento enzym je vázán na membránách hladkého endoplazmatického retikula. Glc-6-P je do ER transportována pomocí enzymu translokázy. Toto oddělení do ER slouží k tomu, aby vznikající glukóza nebyla ihned zpětně fosforylována na Glc-6-P. Volná glukóza je následně vypuštěna do krve, kde může sloužit jako zdroj energie.
Energetická bilance glukoneogeneze
Glukoneogeneze je energeticky náročný děj – spotřebuje šest makroergických fosfátů na jednu molekulu glukózy. Souhrnně ho můžeme vyjádřit následující rovnicí:
- 2 Pyr + 4 ATP + 2 GTP + 2 NADH + 4 H2O → Glc + 4 ADP + 2 GDP + 6 Pi + 2 NAD+ + 2 H+
Substráty pro glukoneogenezi
- Laktát
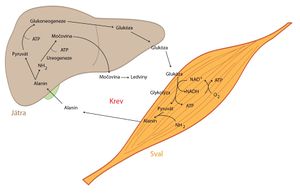
- Laktát, jeden z hlavních zdrojů uhlíkových atomů v procesu glukoneogeneze, vzniká během anaerobní glykolýzy z pyruvátu reakcí katalyzovanou laktátdehydrogenázou (LDH). Jeho hlavními producenty jsou pracující svalové buňky a erytrocyty. Z nich se laktát uvolňuje do krevního oběhu, který ho odnese do jater, kde je přeměněn na glukózu. Glukóza se následně uvolní do krve, odkud ji mohou výše zmíněné buňky opět získat. Tímto jsme uzavřeli tzv. Coriho cyklus.
- Pyruvát
- Pyruvát může být produkován mnoha periferními tkáněmi. Na tomto místě si uvedeme popis tzv. glukóza-alaninového cyklu, který probíhá mezi svalovými buňkami a játry. Poté, co pyruvát vznikne ve svalových buňkách, podléhá transaminaci za vzniku alaninu. Ten se uvolňuje do krve, která jej transportuje do jater, kde se alanin transaminací zpětně přeměňuje na pyruvát, jenž se může zapojit do glukoneogeneze. Vzniklá glukóza je přenesena krví do svalů a celý cyklus se uzavírá.
- Glukogenní aminokyseliny
- Uhlíkaté skelety všech aminokyselin kromě leucinu a lysinu mohou být zdrojem uhlíkových atomů pro proces glukoneogeneze. Hlavní zastoupení přitom mají alanin a glutamin. Přesný mechanismus jejich zapojení je nad rámec tohoto výukového textu. Hlavní zdroj glukogenních aminokyselin tvoří svalové proteiny.
- Glycerol
- Glycerol získaný při hydrolýze triacylglycerolů se může použít jako substrát pro glukoneogenezi. Prvním krokem je jeho fosforylace na glycerol-3-P pomocí glycerolkinázy. Následuje jeho dehydrogenace na dihydroxyaceton-P katalyzovaná glyceraldehyd-3-fosfátdehydrogenázou, čímž vzniká meziprodukt glukoneogeneze.
Energie
Energie pro glukoneogenezi se získává především z β-oxidace mastných kyselin – při hladovění se mastné kyseliny uvolňují ze zásobních triacylglycerolů tukové tkáně a metabolizují se v játrech.
Regulace glukoneogeneze
Glukoneogeneze je metabolická dráha, která se aktivuje především během hladovění nebo za patologických stavů (stres v důsledku infekce, polytraumata apod.).
Regulační enzymy glukoneogeneze jsou ty, jež obcházejí nevratné reakce glykolýzy:
- Pyruvátkarboxyláza – aktivuje ji acetyl-CoA pocházející například z β-oxidace mastných kyselin.
- PEP karboxykináza, Fru-1,6-bisfosfatáza a Glc-6-fosfatáza – regulují je stejné vlivy jako reakce glykolýzy, pouze v opačném směru. Fru-1,6-bisfosfatáza se například aktivuje pomocí citrátu, inhibiční efekt naopak vykazuje AMP či Fru-2,6-bisP.
Kromě aktivity regulačních enzymů je důležitým faktorem určujícím efektivitu glukoneogeneze i dodávka jejích substrátů, jež vznikají např. proteolýzou či lipolýzou.
Kontraregulační hormony (glukokortikoidy, glukagon či katecholaminy) glukoneogenezi zesilují, inzulin ji naopak inhibuje.