Co pohání naše buňky
Termodynamika
Chemické reakce
Chemické reakce jsou děje, při nichž dochází k přeměně jedné skupiny sloučenin, reaktantů, na sloučeniny jiné, produkty. Reakce popisujeme chemickými rovnicemi.
Např. v rovnici
| (1) |
- a A + b B → c C + d D
značí
A, B reaktanty, C, D produkty, a, b, c, d stechiometrické koeficienty, které vyjadřují poměry počtů částic sloučenin, jež se účastní reakce.
Pojem „rovnice” naznačuje existenci rovnosti mezi oběma stranami: při každé chemické reakci musí být zachována hmotnost, energie a elektrický náboj.
Podívejme se nyní na reakce mezi měďnými a železitými ionty v roztoku:
| (2) |
- Cu+ + Fe3+ Cu2+ + Fe2+
Podobně jako většina reakcí v chemii (a téměř všechny v biochemii) je i tato reakce vratná. Znamená to, že může probíhat v obou směrech. K zastavení jejího průběhu dojde poté, co se určité množství železa zredukuje a určité množství mědi se zoxiduje. Hovoříme, že v tomto okamžiku dosáhla reakce rovnovážného stavu, tzn. že koncentrace reaktantů a produktů se v reakčním systému již dále nemění.
Ustavenou rovnováhu můžeme matematicky popsat použitím rovnovážné konstanty, Keq, která je definována jako podíl součinu rovnovážných koncentrací produktů a reaktantů (umocněných na jejich stechiometrické koeficienty):
| (3) |
V případě reakce (2) tedy dostaneme
| (4) |
Předpokládejme, že rovnovážná konstanta pro reakci (1) se rovná 1, tzn. že v rovnovážném stavu se součin koncentrací produktů a reaktantů shoduje. Jestliže nyní do systému přidáme více sloučeniny A, porušíme tak nastolenou rovnováhu, a reakce se proto nastartuje ve směru, který se bude snažit opět obnovit původní stav. V našem případě bude látka A reagovat s látkou B za vzniku látek C a D tak dlouho, dokud se opět součiny koncentrací ([A]·[B] a [C]·[D]) nevyrovnají a nedosáhne se stavu nové rovnováhy. Toto pravidlo se nazývá Le Chatelierův princip.
Systém v rovnováze reaguje na změnu podmínek (tlaku, teploty, koncentrace) tak, aby tuto změnu potlačil.
Chemický potenciál
Pokusme se přiblížit, proč chemické reakce probíhají jako odpověď na změny v systému. Pomůže analogie s houpačkou. Těžká osoba dříve či později převáží lehčího, zatímco dva lidé stejné hmotnosti skončí po čase v rovnovážném stavu na stejné úrovni nad zemí.
Jev můžeme vysvětlit pomocí potenciální energie obou lidí v gravitačním poli Země. Gravitační potenciální energie závisí na hmotnosti a poloze předmětu v gravitačním poli. Systém, jejž jsme použili v příkladu s houpačkou, se bude snažit minimalizovat svoji potenciální energii tím, že přesune těžší osobu co nejníže k zemi.
Podobně lze definovat chemický potenciál μ jako potenciální energii obsaženou v určitém množství látky, která se může během chemické reakce uvolnit. Analogicky k našemu příkladu s houpačkou jsou na obou stranách chemické rovnice látky s různým potenciálem. Pokud součet chemických potenciálů reaktantů převyšuje potenciál produktů, bude reakce probíhat zleva doprava, a naopak. Pokud se potenciály rovnají, systém dosáhl rovnováhy.
Gibbsova energie
Rozdíl chemických potenciálů produktů a reaktantů souvisí s termodynamickou funkcí nazývanou změna Gibbsovy energie (ΔG). Z mnoha možných definic Gibbsovy energie jsou pro biochemii důležité dvě:
- Změna Gibbsovy energie je rovna maximálnímu množství (neobjemové) práce, kterou může systém vykonat;
- Změna Gibbsovy energie je mírou vychýlení se od rovnovážného stavu.
První definice nám říká, že ΔG můžeme použít k předpovědi, zda k reakci dojde a jestli ji lze využít jako zdroj energie pro jiné procesy (svalová kontrakce, přesun iontů přes membránu).
Druhá definice vyjadřuje dva fakty:
a) v rovnovážném stavu se ΔG rovná nule;
b) změna koncentrací látek v systému, který není v rovnováze, změní (zvýší nebo sníží) ΔG.
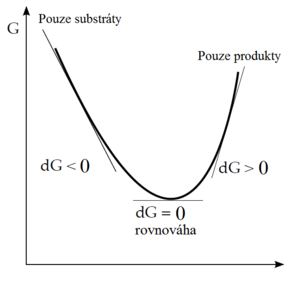
Smysl změny Gibbsovy energie se dá ilustrovat i následujícím zobrazením:
Pokud reakce začne jen se směsí reaktantů, bude probíhat směrem k produktům tak dlouho, dokud bude ΔG negativní. Nabude-li chemický potenciál produktů stejné hodnoty jako u reaktantů, systém dosáhl stavu nejnižší energie a reakce se zastaví. Reakční směs je nyní v rovnováze. Nedá se předpokládat, že by reakce pokračovala dál, protože ΔG je v další části křivky pozitivní.
Platí tedy:
ΔG < 0 – reakce probíhá spontánně; ΔG = 0 – rovnovážný stav; ΔG > 0 – reakce spontánně neprobíhá.
Změnu Gibbsovy energie můžeme také definovat prostřednictvím termodynamických veličin jako entalpie (H) a entropie (S):
| (5) |
- ΔG = ΔH – T · ΔS
Změna entalpie je energie uvolněná nebo spotřebovaná během reakce (negativní hodnota znamená uvolnění energie a naopak).
Entropie se často považuje za míru neuspořádanosti systému. Podle druhého zákona termodynamiky neuspořádanost (a tedy i entropie) všech uzavřených systémů narůstá.
Z rovnice (5) vyplývá, že chemická reakce může být poháněna (tzn. dosáhnout negativní ΔG) buď vhodnou (tedy negativní) změnou entalpie, nebo dostatečným nárůstem entropie, či oběma současně.
Z tabulkových hodnot ΔG0 nebo ΔG0′ můžeme vypočítat ΔG pro jakoukoliv reakci pomocí rovnice:
| (6) |
V rovnovážném stavu je ΔG rovné nule a výraz je roven rovnovážné konstantě Keq.
Rovnice (6) tedy v rovnovážném stavu nabývá podoby:
| (7) |
- ΔG = −R · T · ln Keq
Prostřednictvím této rovnice pak můžeme vypočítat rovnovážnou konstantu z ΔG či naopak.
Snadná dostupnost hodnot ΔG0 může vést k uspěchaným závěrům o nemožnosti průběhu reakce při nalezení pozitivních hodnot ΔG0 v tabulkách. Tomu je ale třeba se vyhnout.
Ukažme si to na následujícím příkladu: Metabolická dráha glykolýzy obsahuje krok, ve kterém dochází k přeměně glukóza-6-fosfátu na izomer, fruktóza-6-fosfát. ΔG0‘ této reakce činí +1,7 kJ/mol. Znamená to tedy, že naše buňky prováděním této reakce každou sekundu našeho života porušují zákony termodynamiky?
Je důležité mít na paměti rozdíl mezi ΔG a ΔG0 a ΔG0‘. Jen samotné ΔG nám může prozradit něco o termodynamickém profilu konkrétní reakce. Hodnoty ΔG0 a ΔG0‘ platí jen při zachování standardních podmínek, které ale jsou v přírodě velmi zřídka (jestli vůbec) přítomny. Abychom mohli posoudit pravděpodobnost, že k reakci dojde, musíme znát skutečné koncentrace všech látek, jež se jí účastní.
V našem případě enzymů dochází jejich činností k neustálému odstraňování fruktóza-6-fosfátu, a tak se jeho koncentrace udržuje nízká. Celkové ΔG izomerizace Glc-6-P na Fru-6-P je díky tomu za podmínek, které jsou v buňce, záporné (−2,5 kJ/mol). Vidíme tedy, že mohou probíhat i některé energeticky relativně nepříznivé reakce, jsou-li sdruženy s reakcemi energeticky příznivými (v tomto případě těmi, které odčerpávají produkty nebo dodávají reaktanty).
Pokud reakce přeměny A → B dosahuje rovnovážného stavu s nízkou koncentrací látky B, můžeme ji sdružit s reakcí přeměny B → C, která naopak dosahuje rovnovážného stavu pouze při nízkých koncentracích reaktantu B. Druhá reakce potom efektivně odstraňuje látku B tvořenou první reakcí a brání jí tak v dosažení rovnovážného stavu.
V našem příkladu glykolýzy enzym fosfofruktokináza velmi efektivně fosforyluje Fru-6-P na fruktózu-1,6-bisfosfát, čímž zamezuje hromadění Fru-6-P, který by předchozí reakci brzdil.
Elektrochemická rovnováha
Chemické reakce, při nichž dochází ke změně oxidačních čísel prvků, se nazývají redoxní reakce. Při oxidaci se oxidační číslo zvyšuje, při redukci se snižuje. Tyto změny obvykle zahrnují přenos elektronů z jednoho atomu či molekuly na další.
Ponoříme-li zinkovou tyč do roztoku síranu zinečnatého, spustí se reakce, při které kovový zinek odevzdává dva elektrony a mění se na Zn2+, dokud se znovu nenastolí rovnováha. Proces vede k hromadění elektrického náboje, který označujeme jako elektrodový potenciál (E). Ten lze měřit nepřímo, jako rozdíl vůči jinému potenciálu. Rozdíl potenciálů nazýváme napětí a měříme jej ve voltech (V).
K překonání problému s měřením absolutního potenciálu vymysleli chemici malý trik: zvolili si jednu z elektrod a rozhodli, že se její potenciál považuje za nulový. Jde o tzv. standardní vodíkovou elektrodu. I elektrodový potenciál je tedy ve skutečnosti rozdíl potenciálů (a někdy se proto označuje ΔE).
Množství elektrického náboje (i hodnota elektrodového potenciálu) souvisí s rovnovážnou konstantou reakce. Vzpomeňme si, že ΔG odpovídá maximálnímu množství práce, kterou systém může vykonat. V elektrickém poli je práce konána přesouváním náboje přes rozdíl potenciálů (podobně jako je mechanická práce konána přesouváním hmoty v gravitačním poli). Vztah mezi ΔG a E pak vyjadřuje rovnice:
| (8) |
- ΔG = −n · F · E
kde n je počet elektronů přenesený v redoxní reakci, F je Faradayova konstanta (rovná se náboji 1 molu elektronů, přibližně 9,648 530 9 · 104 C · mol−1), E značí celkový rozdíl potenciálů mezi oběma poloreakcemi.
Pro standardní elektrodový potenciál můžeme vztah odvodit obdobně:
| (9) |
Mimo standardní podmínky má tato tzv. Nernstova rovnice (9) tvar:
| (10) |
Jak lze tyto rovnice použít k odhadu toho, zda určitá redoxní reakce bude či nebude probíhat? Rozhodující hodnotu opět představuje hodnota ΔG příslušné reakce. Lze ji vypočítat z rovnice (8).
Uvažujme reakci:
| (11) |
- Zn + Cu2+ Zn2+ + Cu
Dvě poloreakce, které probíhají, jsou:
| (12) |
- Zn Zn2+ + 2 e−
| (13) |
- Cu2+ + 2 e− Cu
Zinek se oxiduje, zatímco měď redukuje. Standardní elektrodové potenciály se v tabulkách obvykle uvádějí jako redukce, takže hodnota E0 pro oxidaci zinku musí být vynásobena −1. Obě poloreakce pak dohromady tvoří celkový potenciál reakce. V tomto případě je E0Zn/Zn2+ = +0,76 V (po obrácení znaménka) a E0Cu2+/Cu = +0,34 V. Celkový rozdíl potenciálů tedy činí +1,1 V. Pro reakci (11) probíhající ve standardních podmínkách je celkový potenciálový rozdíl kladný, což znamená, že ΔG (v našem případě ΔG0) je záporné a reakce bude probíhat spontánně. Za nestandardních podmínek musíme použít úplnou Nernstovu rovnici pro obě poloreakce.
Kinetika
Kinetika se zabývá tím, jakou rychlostí a zda vůbec bude konkrétní reakce probíhat.
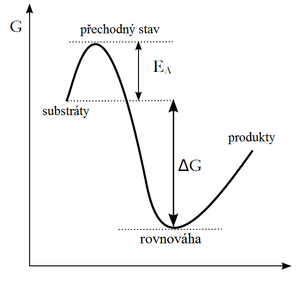
Existuje mnoho termodynamicky příznivých reakcí, které ale spontánně neprobíhají.
Některé reakce mohou být termodynamicky uskutečnitelné, ale kineticky nepravděpodobné. Tento fenomén, nazývaný kinetická bariéra, je způsoben existencí nestálých přechodných stavů (aktivovaných komplexů). Ty se vytvoří jen při dodání většího množství energie (vznik aktivovaného komplexu je termodynamicky nepříznivý). Tato dodatečná energie se nazývá aktivační energie (EA).
Reakční rychlost
Studiem reakční rychlosti se zabývá chemická kinetika.
Aby mohly spolu dvě či více látek reagovat, musí dojít ke srážce jejich molekul. Pravděpodobnost srážky se zvyšuje s rostoucí teplotou, tlakem a koncentrací látek.
Reakční rychlost (v) můžeme definovat jako rychlost úbytku reaktantů či rychlost přírůstku produktů, tedy např. pro reakci a A + b B → c C + d D:
Zabývejme se podrobněji vztahem mezi rychlostí reakce a koncentrací reaktantů. Uvažujme jednoduchou reakci X → Y. Její rychlost bude úměrná [X] podle rovnice:
| (15) |
kde k je rychlostní konstanta.
V některých případech může být rychlost úměrná [X]2, může na [X] záviset složitěji, nebo naopak nemusí být na [X] závislá vůbec vůbec (v takovém případě probíhá reakce konstantní rychlostí). Přesný vztah mezi reakční rychlostí a koncentrací reaktantů je empirický fakt a – zejména bereme-li v úvahu reakce se složitějšími reakčními mechanismy – nedá se odvodit jen ze stechiometrie pozorované přeměny.
Chemici definují kinetický řád reakce podle počtu členů, jejichž koncentrace ovlivňují rychlost. Pokud rychlost na koncentraci nezávisí, a tedy platí rovnice v = k, hovoříme o řádu nultém. Je-li rychlost přímo úměrná koncentraci jednoho z reaktantů, jedná se o kinetiku prvního řádu (jako v případě výše uvedené reakce (15)). Jestliže je rychlost ovlivněna koncentrací dvou reaktantů nebo se jedná o exponenciální vztah jednoho reaktantu (v = k · [X] · [Y] nebo v = k · [X]2), hovoříme o kinetice druhého řádu atd.
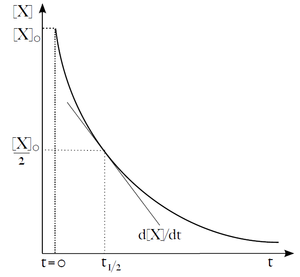
Někdy chceme předpovědět, jaké množství reaktantu X zůstane nezreagováno po čase t od začátku reakce, nebo jak dlouho potrvá, než [X] klesne na polovinu. Při reakcích nultého řádu je výpočet jednoduchý, ale pro řády vyšší se komplikuje.
Pro reakci prvního řádu platí:
| (16) |
Integrací rovnice (16) dostáváme:
| (17) |
Řešením pro počátek reakce, tj. pro t = 0 (přičemž výchozí koncentraci látky X v tomto čase označíme jako [X]0) dostáváme
| (18) |
| (19) |
Tato rovnice popisuje exponenciální pokles koncentrace X v čase. Užitečným parametrem exponenciálního rozkladu je čas potřebný na snížení počáteční koncentrace (či množství) látky X na polovinu. Nazývá se poločas (t1/2). Z rovnice (19) můžeme poločas vyjádřit jako:



![{\displaystyle K={\frac {[C]^{c}\cdot [D]^{d}}{[A]^{a}\cdot [B]^{b}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4fec82e5127445e93a526d3557f1837652785bd9)
![{\displaystyle K={\frac {[Cu^{2+}]\cdot [Fe^{2+}]}{[Cu^{+}]\cdot [Fe^{3+}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c8412ded543ebd8aa257f750ae8f82893851adc9)

![{\displaystyle \Delta G=\Delta G^{0}+R\cdot T\cdot ln{\frac {[C]^{c}\cdot [D]^{d}}{[A]^{a}\cdot [B]^{b}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bcd22dcc82d9e6d9762126f24414f6b0c16f0d1a)
![{\displaystyle {\frac {[C]^{c}\cdot [D]^{d}}{[A]^{a}\cdot [B]^{b}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7111a4fb16c8e7a84736b85eaad4f6f73a1ddfd5)

![{\displaystyle E={\frac {R\cdot T}{n\cdot F}}\cdot ln{\frac {[redukovan{\acute {e}}]}{[oxidovan{\acute {e}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cacc063c675c52cc69feefbfb38974380487e73e)
![{\displaystyle v=-{\frac {1}{a}}\cdot {\frac {d[A]}{dt}}=-{\frac {1}{b}}\cdot {\frac {d[B]}{dt}}={\frac {1}{c}}\cdot {\frac {d[C]}{dt}}={\frac {1}{d}}\cdot {\frac {d[D]}{dt}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4707b4595695ab5e07bc99342d80e763feb418c0)
![{\displaystyle v=-{\frac {d[X]}{dt}}=k\cdot [X]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/455ad6de0a9c5b0eecd84b2bb4229257516bfd65)
![{\displaystyle -{\frac {d[X]}{dt}}=k\cdot [X]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e901a271febbaa8531f29f808e1bd2b66568ed1b)
![{\displaystyle -{\frac {1}{[X]}}\cdot {\frac {d[X]}{dt}}=k\cdot [X]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c9b87da63afed0a70224765a4433d055501ccf30)
![{\displaystyle -\int {{\frac {1}{[X]}}\cdot {\frac {d[X]}{dt}}}=\int {k\cdot [X]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cdb831679df28930d5c9a2e0d56941f14273c36f)
![{\displaystyle -ln[X]=k\cdot t+c}](https://wikimedia.org/api/rest_v1/media/math/render/svg/30dcc458e5e2aa7d2d75f16b70823b88e89aa6d8)
![{\displaystyle c=-ln[X]_{0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f15993399d0ef0333e597a54eb50e19e1ebab64b)
![{\displaystyle -ln[X]=k\cdot t-ln[X]_{0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b3a57b5821357a65c5d8ffbd86e6c34fa4be7416)
![{\displaystyle -ln[X]+ln[X]_{0}=k\cdot t}](https://wikimedia.org/api/rest_v1/media/math/render/svg/473243524faadf0edf37c54e2d6612c017b76bf0)
![{\displaystyle -ln{\frac {[X]}{[X]_{0}}}=k\cdot t}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f2de7a0bbb3b34af731e0e74ec0cb53cea459123)
![{\displaystyle {\frac {[X]}{[X]_{0}}}=e^{-k\cdot t}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1077126a021a629dfbe6e98dccd3132b47f5713a)
![{\displaystyle [X]=[X]_{0}\cdot e^{-k\cdot t}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6bf69f402892c84545b5a0aef7196819cbe28fd5)