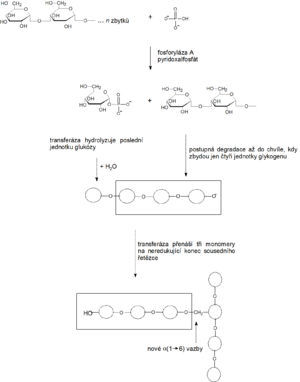Ukládání energie v lidském těle – metabolismus glykogenu a tvorba mastných kyselin a triacylglycerolů
Náplň podkapitoly
- Úvod do ukládání energie v lidském těle
- Metabolismus glykogenu
- Tvorba mastných kyselin a triacylglycerolů
Úvod do ukládání energie v lidském těle
Energie v lidském těle se převážně ukládá ve dvou zásobních látkách – triacylglycerolech (TAG) a glykogenu. TAG jsou pro skladování výhodnější. Kompletní oxidací 1 g TAG se získá přibližně 38 kJ (9 kcal), z 1 g sacharidů či proteinů jen 17 kJ (4,1 kcal). Během hladovění se nejdříve odbourají některé plazmatické proteiny (např. albumin ) a také svalové proteiny.
- 400 000 kJ v TAG (asi 10,5 kg, tvoří kolem 15 % hmotnosti těla)
- 100 000 kJ v proteinech (svaly)
- 8 000 kJ v glykogenu (2 500 kJ v jaterním glykogenu a více než dvojnásobek ve svalovém glykogenu)
- 170 kJ v glukóze
Pokud počítáme, že denně spotřebuje naše tělo přibližně 2 000 kcal, vystačily by zásoby jaterního glykogenu a glukózy maximálně na jeden den. TAG ale dovedou tyto nároky krýt po dobu týdnů.
Metabolismus glykogenu
Glykogen je rozvětvený homopolymer molekul glukózy. Většina glukózových zbytků je vázána pomocí α 1→4 vazeb. Každý dvanáctý glukózový zbytek je připojen k dalšímu zbytku pomocí α 1→6 vazby – vzniká místo rozvětvení molekuly glykogenu. Tyto větve jsou prodlouženy dalšími glukózovými zbytky spojenými α 1→4 vazbami. Vytvářejí se tak nerozpustné molekuly glykogenu připomínající svou strukturou větve stromu. Veškeré reakce při metabolismu glykogenu probíhají pouze na neredukujících koncích jeho molekuly – ty mohou být zkracovány či prodlužovány.
Funkce glykogenu
Glykogen slouží u živočichů jako zásobárna sacharidů, ze které se mohou štěpením uvolňovat estery glukózy. Bohatě hydratovaná glykogenová granula se nacházejí v cytoplazmě všech buněk. Lidské tělo může skladovat přibližně 450 g glykogenu. Z tohoto množství se 80–100 g nalézá v játrech – tzv. jaterní glykogen, který se využívá pro udržování stálé hladiny glukózy v krvi (glykémie). Dalších 300 g je ve svalových buňkách – tzv. svalový glykogen. Ten slouží spíš jako interní svalová energetická zásoba při konání svalové práce. Svalové buňky neobsahují glukóza-6-fosfatázu, a proto svaly nemohou uvolňovat čistou glukózu do krevního oběhu. Zbytek (cca 50 g glykogenu) připadá na ostatní buňky lidského těla.
Glykogen jako zásobárna energie
Jak již bylo uvedeno výše, glykogen není hlavní energetickou zásobou organismu (jaterní glykogen se vyčerpá během 12–24 hodin hladovění). Jde totiž o polární, bohatě hydratovanou molekulu a vázaná voda jen „zabírá místo” a nepřináší energetický zisk. Zásoba energie v tukové tkáni je mnohem úspornější – není totiž hydratovaná (TAG mají hydrofobní charakter) a současně jsou mastné kyseliny tvořeny redukovanějším uhlíkatým skeletem −CH2 – proti sacharidům −CH(OH)−. Jejich oxidací se uvolní větší množství energie. Glykogen nicméně představuje zásobárnu glukózy, což je důležité například pro buňky na glukóze závislé (např. mozek, erytrocyty).
Histochemický průkaz
V histochemii se jeho přítomnost dokazuje tzv. PAS-reakcí (oxidace sousedních dvou hydroxylových skupin kyselinou jodistou a následná reakce takto vzniklých aldehydových skupin se Schiffovým činidlem).
Glykogeneze (syntéza glykogenu)
Proces syntézy glykogenu probíhá v cytozolu. Intenzivní je hlavně v játrech a kosterní svalovině. Syntéza glykogenu vychází z molekul glukózy a vyžaduje navíc tzv. primer – tj. molekulu, která obsahuje řetězec několika glukóz spojených glykosidovými vazbami (nejčastěji jím je zbytek glykogenu přítomný v buňce, případně protein glykogenin).
Průběh
- 1. Fosforylace glukózy na Glc-6-P
- v játrech katalyzuje tuto reakci glukokináza,
- ve svalech hexokináza.
- 2. Přeměna Glc-6-P na Glc-1-P
- pomocí fosfoglukomutasy
- 3. Glc-1-P reaguje s UTP
- za katalýzy UDP-glukózapyrofosforylázou,
- vzniká UDP-Glc, neboli aktivovaná forma glukózy (UDP se váže na C1).
- Tvorba glykosidových vazeb mezi molekulami glukózy je endergonický proces, a proto se vyžadují energeticky bohaté substráty. Přenos glukózových zbytků z UDP-Glc je přímý (ΔG < 0).
- 4. UDP-Glc se svým C1 připojuje na C4 neredukujícího konce glykogenu
- za katalýzy enzymem glykogensyntázou, a zároveň uvolní UDP.
- Vzniká tedy α 1→4 vazba O-glykosidová vazba.
- 5. Jakmile dosáhne rostoucí řetězec určité délky (> 11 glukózových zbytků), dojde k větvení molekuly.
- Z řetězce se pomocí tzv. větvícího enzymu (branching enzyme, amylo-(1,4-1,6)-transglykosyláza) odstraní oligosacharidový štěp složený ze 6–7 glukózových zbytků, který se následně připojí na −OH skupinu umístěnou na C6 molekuly glukózy lokalizované uvnitř řetězce glykogenu – vzniká α 1→6 vazba. Tyto větve mohou být nově prodlužovány pomocí akce glykogensyntázy (viz výše).
Regulace syntézy glykogenu
Syntéza glykogenu probíhá v době, kdy má organismus dostatečný přísun energetických substrátů z potravy, tj. může tvořit energetické zásoby na horší časy. Hlavním regulačním enzymem je glykogensyntáza. Její aktivita se reguluje pomocí fosforylace – pokud je enzym fosforylován, inaktivuje se, defosforylace naopak vede k aktivaci enzymu. Fosforylaci ovlivňuje poměr inzulin / glukagon (např. skrze intracelulární koncentraci cAMP). Zvýšení poměru aktivuje syntézu glykogenu (inzulin je anabolický hormon). Snížení poměru či katecholaminy ji naopak inhibují.
Glykogenolýza (degradace glykogenu)
Glykogen není nikdy úplně degradován, jeho degradace probíhá v cytosolu buněk. Děje se tak postupně formou tzv. fosforolytického štěpení (fosforolýza, navázání anorganického fosfátu), kdy se pomocí enzymu glykogenfosforylázy (zkráceně fosforyláza) z neredukujících konců uvolňují jednotlivé monomerní jednotky glukózy ve formě Glc-1-P – tzv. Coriho ester. Při štěpení molekuly glykogenu tedy rovnou vzniká fosforylovaná glukóza, a to bez spotřeby ATP:
- N zbytků glukózy + HPO42- → Glc-1-P + (N−1) zbytků glukózy
Bohatě rozvětvená molekula glykogenu má mnoho neredukujících konců, a proto se glykogen odbourává rychle. Na tomto místě je užitečné zmínit, že štěpení polysacharidů v trávicím traktu probíhá zcela odlišně. Polysacharidy jsou zde nejdříve štěpeny uvnitř svých řetězců za vzniku kratších poly- a oligosacharidů. Následně se uvolňuje volná (nikoli fosforylovaná) glukóza.
Průběh glykogenolýzy
- 1. Glykogenfosforyláza dovede štěpit pouze α-1→4 glykosidové vazby.
- Začíná štěpit glykogen od neredukujícího konce a vznikají Glc-1-P.
- 2. Glc-1-P se přeměňuje na Glc-6-P
- činností fosfoglukomutázy.
- 3. Odbourávání glykogenu
- zastaví se u 4. glukózového zbytku před místem větvení, kde se vyskytuje α 1→6 vazba.
- 4. Tzv. odvětvovací enzym (glukanotransferáza, transglykosidáza)
- oddělí od postranního řetězce štěp tvořený třemi glukózovými zbytky a přenese jej na konec lineárního (hlavního) řetězce. Tam ho napojí pomocí α 1→4 vazby.
- 5. V místě původního větvení zbývá již jen jeden zbytek vázaný α 1→6 vazbou
- je odštěpen pomocí enzymu amylo-α1→6-glukosidázy.
- Výsledně se vytváří nerozvětvený řetězec s možností dalšího štěpení prostřednictvím glykogenfosforylázy.
- 6. Glc-6-P se přeměňuje na glukózu
- pomocí glukóza-6-fosfatázy (katalyzuje odštěpení fosfátu).
- Tento enzym se vyskytuje v jaterních a ledvinných buňkách a v enterocytech, kde se váže na membrány hladkého endoplazmatického retikula.
- 7. Glc-6-P
- je do ER transportována pomocí enzymu translokázy.
- Toto oddělení do ER slouží k tomu, aby vznikající glukóza nebyla ihned zpětně fosforylována na Glc-6-P.
- 8. Volná glukóza je následně vypuštěna do krve, kde může sloužit jako zdroj energie.
Regulace glykogenolýzy
Klesne-li koncentrace glukózy v krvi, dochází ke snížení poměru inzulin/glukagon v plazmě. Jaterní glykogen je za těchto podmínek odbouráván. Sníží-li se při hladovění nebo za stresových podmínek organismu obsah glykogenu v játrech, je glukóza syntetizována de novo reakcemi glukoneogeneze z necukerných zdrojů. Hlavním regulačním enzymem glykogenolýzy je glykogenfosforyláza, patřící mezi ty enzymy, jejichž aktivitu reguluje kovalentní modifikace molekuly. Přitom platí, že fosforyláza je aktivní fosforylovaná.
- Aktivovaná fosforyláza se označuje jako fosforyláza a .
- Neaktivní fosforylázu (nemá navázanou fosfátovou skupinu) nazýváme fosforyláza b.
Fosforylaci glykogenfosforylázy katalyzuje enzym fosforylázakináza, defosforylaci oproti tomu katalyzují proteinfosfatázy. Glykogenolýzu aktivují kontraregulační hormony – glukagon, katecholaminy a glukokortikoidy (např. kortizol), inzulin ji oproti tomu inhibuje.
Ve svalových buňkách se regulace glykogenolýzy spojuje i se změnou koncentrace Ca2+ iontů. Zvýšení jejich intracelulární koncentrace vyústí v aktivaci fosforylázykinázy a glykogenfosforylázy – aktivace glykogenolýzy. Prostředníky jejich účinku jsou jednak vazebná bílkovina kalmodulin, jednak kalmodulin-dependentní proteinkinázy.
Klinická korelace
Vrozené poruchy metabolismu glykogenu se nazývají glykogenózy. Dochází při nich ke hromadění glykogenu v buňkách (hlavně v jaterních a svalových), což může vyústit v pestré spektrum příznaků – např. zvětšení jater, hypoglykémie či zaostávání ve vývoji. Jejich incidence činí přibližně 1 : 10 000. Nejznámějším typem je typ I – tzv. von Gierkeho choroba, kdy je defektní glukóza-6-fosfatáza.
Shrnutí regulací metabolismu glykogenu
Z výše uvedeného jasně vyplývá, že regulace obou procesů, syntézy i degradace glykogenu, je protichůdná. Jednotlivé efekty shrnuje následující tabulka:
| Regulační enzym | Aktivace | Inhibice |
|---|---|---|
| Glykogenfosforyláza (glykogenolýza) | Glukagon, adrenalin (fosforylace), snížení poměru ATP/AMP Ca2+ (ve svalu) | Zvýšení poměru ATP/AMP Inzulin |
| Glykogensyntáza (syntéza glykogenu) | Inzulin (indukce) | Glukagon, adrenalin (fosforylace) |
Tvorba mastných kyselin a triacylglycerolů
Tvorbu mastných kyselin a triacylglycerolů vnímáme jako energeticky vysoce náročný proces lokalizovaný převážně v buňkách jater, tukové tkáně, CNS či laktující mléčné žlázy. Probíhá především v postprandiálním období.
Proces tvorby mastných kyselin je v mnoha ohledech obrácenou β-oxidací – namísto oxidace probíhá redukce, podobně hydratace je nahrazena dehydratací. Nejde však o přesné obrácení dějů, oba procesy se v mnoha významných ohledech odlišují. Tyto odlišnosti si ukážeme dříve, než si popíšeme jednotlivé reakce.
- Rozdíly mezi odbouráváním a syntézou mastných kyselin
-
- Syntéza MK probíhá v cytoplazmě, odbourávání v matrix mitochondrie.
- Meziprodukty syntézy MK jsou vázány na tzv. acyl carrier protein (ACP, protein přenášející acyly), meziprodukty degradace na molekulu koenzymu A.
- Enzymy syntézy MK jsou spojeny do multienzymového komplexu zvaného syntáza MK, enzymy degradace jsou uloženy volně v matrix.
- Řetězec mastné kyseliny se prodlužuje vždy o dva uhlíkové atomy – výchozím substrátem je AcCoA (aktivovaným donorem je malonyl~CoA).
- Redukčním činidlem syntézy je NADPH, oxidačními činidly degradace jsou FAD a NAD+.
- Prodlužování řetězce na syntáze MK končí tvorbou palmitátu (C16), další prodlužování řetězce a tvorba nenasycených kyselin probíhá účinkem jiných enzymů v ER a v mitochondriích.
Nyní se podíváme na jednotlivé reakce syntézy mastných kyselin.
Tvorba malonyl~CoA
- 1. Vstupní látkou pro syntézu mastných kyselin je AcCoA.
- V prvním kroku dochází za spotřeby ATP k jeho karboxylaci na malonyl-CoA:
- AcCoA + ATP + HCO3– → malonyl~CoA + ADP + Pi + H+
- Tuto reakci katalyzuje regulační enzym AcCoA-karboxyláza, jejímž kofaktorem je biotin – vitamin H čili B7 (obecně jde o kofaktor karboxyláz).
- Tvorba malonyl~CoA se odehrává ve dvou stupních. Nejdříve probíhá ATP-dependentní karboxylace biotinu:
- Biotin-enzym + ATP + HCO3– → CO2-biotin-enzym + ADP + Pi
- 2. Následně dojde k přenosu karboxylu na acetyl-CoA
-
- CO2-biotin-enzym + AcCoA → malonyl-CoA + biotin-enzym
- Biotin je s enzymem spojen amidovou vazbou mezi karboxylem biotinu a ε-aminoskupinou lysinu. CO2 se z molekuly opět odstraní při kondenzaci s rostoucím řetězcem mastné kyseliny.
Syntáza mastných kyselin
Syntáza mastných kyselin u savců má strukturu homodimeru složeného ze dvou identických podjednotek (260 kDa). Každá podjednotka sestává ze tří domén spojených pohyblivými regiony:
- Doména 1 – vstup substrátu a kondenzační jednotka – obě transferázy (acetyltransferáza a malonyltransferáza) a β-ketoacylsyntáza (kondenzační enzym – CE).
- Doména 2 – redukční jednotka – obsahuje ACP, β-ketoacylreduktázu, dehydratázu a enoylreduktázu.
- Doména 3 – thioesteráza odštěpující palmitát.
Místa vazby meziproduktů na syntázu MK představují:
- Thiolová skupina cysteinu CE
- Thiolová skupina fosfopanteteinu, který se váže na serin v ACP. Fosfopanteteinové raménko nalezneme i v molekule koenzymu A. Toto flexibilní raménko umožňuje přesun meziproduktů mezi jednotlivými katalytickými místy syntázy
Jednotlivé kroky syntézy mastných kyselin
- 1. Syntéza malonyl-CoA
- katalyzována acetyl-CoA karboxylázou – neprobíhá na syntáze MK
- 2. Navázání AcCoA na CE
- acetyltransacyláza
- 3. Navázání malonyl-CoA na ACP
- malonyltransacyláza
- 4. Kondenzační reakce
- kondenzační enzym
- 5. Syntáza MK funguje jako dimer.
- V tomto kroku dochází ke kondenzaci mezi malonylem zavěšeným na ACP jedné podjednotky a acetylem na kondenzačním enzymu druhé podjednotky. Nový acyl zůstává navázán na ACP:
- Acetyl-CE + malonyl-ACP → acetoacetyl-ACP + CE + CO2
- 6. První redukce
- β-ketoacylreduktáza
- Acetoacetyl-ACP + NADPH + H+ → D-3-hydroxybutyryl-ACP + NADP+
- 7. Dehydratace
- 3-hydroxyacyldehydratáza
- D-3-Hydroxybutyryl-ACP → krotonyl-ACP + H2O
- 8. Druhá redukce
- enoylreduktáza
- Krotonyl-ACP + NADPH + H+ → butyryl-ACP + NADP+
- 9. Přenos řetězce z ACP na SH skupinu kondenzačního enzymu stejné podjednotky
- 10. Nový malonyl se váže na ACP druhé podjednotky.
- Následně dojde ke kondenzaci na protilehlou podjednotku dimeru, než bylo při první kondenzaci. Podjednotky se tedy při syntéze pravidelně střídají.
Další postup syntézy MK
Postupně dochází k prodlužování řetězce nové syntetizované mastné kyseliny. Při délce C16 nastává ukončení – koncovým produktem syntázy MK je tedy palmitát. Thioesteráza ho odštěpí z vazby na ACP (hydrolýza thioesterové vazby na fosfopanteteinu).
Tvorba palmitátu souhrnně vyžaduje 8 molekul AcCoA, 14 molekul NADPH a 7 molekul ATP:
- 8 AcCoA + 7 ATP + 14 NADPH + 14 H+ → palmitát + 14 NADP+ + 8 CoA + 6 H2O + 7 ADP + 7 Pi
AcCoA vzniká v matrix mitochondrie, syntéza MK probíhá v cytoplazmě. Vnitřní mitochondriální membrána ale je pro AcCoA nepropustná, do cytoplazmy se proto transportuje ve formě citrátu (viz dále). 8 molekul NADPH se získá transportem citrátu do cytoplazmy, zbylých 6 v pentózovém cyklu.
Citrát jako nositel acetylů z matrix mitochondrie do cytosolu
Pokud je v matrix mitochondrie dostatek AcCoA, reaguje s OAA za vzniku citrátu (katalyzuje citrátsyntáza).
- Ten se transportuje do cytoplazmy, kde je štěpen pomocí ATP-citrátlyázy (spotřeba ATP):
- Citrát + ATP + HSCoA + H2O → AcCoA + ADP + Pi + OAA
Do cytosolu tak spolu vstoupí AcCoA i OAA. AcCoA se využije v cytoplazmě, kdežto OAA se musí zpětně navrátit do matrix. Jaký je jeho osud?
Vnitřní membrána mitochondrie pro něj znamená nepropustnou hráz. OAA je proto redukován za účasti NADH na malát cytosolovou malátdehydrogenázou:
- OAA + NADH + H+ → malát + NAD+
Malát je následně oxidačně dekarboxylován NADP+-malátovým enzymem (tzv. jablečný enzym) na pyruvát:
- Malát + NADP+ → Pyr + CO2 + NADPH
Pyruvát může vstoupit do mitochondrie, kde je karboxylován pyruvátkarboxylázou:
- Pyruvát + CO2 + ATP + H2O → OAA + ADP + Pi + 2 H+
Sumární rovnice transportu:
- NADP+ + NADH + ATP + H2O → NADPH + NAD+ + ADP + Pi + H+
Regulace tvorby MK
Syntéza mastných kyselin probíhá za situace, kdy tělo disponuje dostatkem substrátů i dostatkem energie. Klíčovou regulační roli hraje AcCoA-karboxyláza:
- Inzulin stimuluje syntézu MK aktivací karboxylázy.
- Citrát ji aktivuje – značí dostatek stavebních jednotek a energie.
- Glukagon a adrenalin mají opačný účinek – inhibují karboxylázu (skrze její fosforylaci).
- Palmitoyl-CoA ji inhibuje – je produktem syntézy MK, a pokud není odváděn, není potřeba tvořit další – feedback inhibice.
- AMP ji inhibuje.
Inzulin dává signál, aby se tělo za každou cenu zbavilo glukózy. Když nestačí glykolýza ani tvorba glykogenu, je přebytek glukózy přeměněn na pyruvát, jejž pyruvátdehydrogenázovou reakcí nevratně změníme na AcCoA. Z toho se tvoří mastné kyseliny. Inzulin posiluje i aktivitu pyruvátdehydrogenázového komplexu.
Elongace a desaturace mastných kyselin
Syntáza MK dovede nasyntetizovat jen palmitát. Ostatní MK se syntetizují prostřednictvím jiných enzymů. Prodlužování řetězce (elongace) a tvorba nenasycených MK (desaturace) probíhá na straně membrány ER přivrácené do cytosolu a v mitochondriích.
Popis přesného průběhu elongace přesahuje rozsahové možnosti tohoto textu. Omezíme se jen na konstatování, že je katalyzován elongázami.
Desaturázy zavádějí dvojné vazby do řetězce MK (v konfiguraci cis). Savci postrádají enzymy katalyzující vstup dvojné vazby za C9 mastné kyseliny. Nové dvojné vazby jsou vždy zaváděny mezi již existující dvojnou vazbou a karboxylovou skupinou. Savci tedy nemohou syntetizovat kyselinu linolovou (18:2 cis Δ9, Δ12, patří mezi ω-6 MK) ani α-linolenovou (18:3 cis Δ9, Δ12, Δ15, patří mezi ω-3 MK) – obě jsou esenciální. Naopak dovedeme syntetizovat kyselinu arachidonovou (20:4 cis Δ5, Δ8, Δ11 a Δ14, ω-6 kyselina – vzniká desaturací a elongací kyseliny linolové), kyselinu eikosapentaenovou (20:5 cis Δ5, Δ8, Δ11, Δ14a Δ17, ω-3 – vzniká z kyseliny linolenové) či kyselinu dokosahexaenovou (22:6 cis Δ4, Δ7, Δ10, Δ13, Δ16a Δ19, ω-3 – vzniká opět z kyseliny linolenové).
Jako příklad si můžeme uvést tvorbu oleoyl-CoA (cis Δ9) ze stearoyl-CoA:
- Stearoyl-CoA + NADH + H+ + O2 → oleoyl-CoA + NAD+ + 2 H2O
Popis přesného průběhu opět přesahuje rámec tohoto textu.
Syntéza triacylglycerolů
Aby mohly nově nasyntetizované mastné kyseliny plnit úlohu energetických zásob, musí být nejdříve převedeny na triacylglyceroly. Podobně jako v případě mastných kyselin se většina TAG tvoří v buňkách jater a v adipocytech. K jejich syntéze potřebuje jednak aktivovaný glycerol – glycerol-3-P, jednak aktivované mastné kyseliny. Tvorba se uskutečňuje na endoplazmatickém retikulu.
Glycerol-3-P vzniká převážně redukcí dihydroxyacetonfosfátu, reakci katalyzuje glyceraldehyd-3-P-dehydrogenáza. Druhým zdrojem může být glycerol uvolněný lipolýzou. Ten je aktivován fosforylací katalyzovanou glycerolkinázou. Glycerol-3-P se následně postupně spojí se dvěma molekulami acyl-CoA (katalyzují acyltransferázy), tvoří se kyselina fosfatidová. Z ní se odštěpí fosfátová skupina za vzniku 1,2-diacylglycerolu, který se esterifikuje pomocí poslední molekuly acyl-CoA – vzniká triacylglycerol. TAG vytvořené v játrech se transportují do tukové tkáně zabalené v lipoproteinových částicích VLDL.