Přehled energetického metabolismu
Náplň podkapitoly
- Základní termíny energetického metabolismu.
- Energetický metabolismus.
- Postavení orgánů v energetickém metabolismu.
Základní termíny energetického metabolismu
Metabolismus
Metabolismus (z řeckého metabolē – změna) neboli látková výměna, je souborem všech chemických reakcí probíhajících v organismu. Tyto reakce jsou většinou regulované a katalyzované enzymy.
Chemické reakce metabolismu jsou často řazeny do metabolických drah, ve kterých je jedna látka sledem reakcí přeměněna na látku jinou. Součástí těchto drah mohou být různé meziprodukty – intermediáty. Jedna látka může být počátečním substrátem pro více metabolických drah. Tato vzájemná přeměna živin s různými meziprodukty se pak označuje jako intermediární metabolismus. Metabolické reakce můžeme obecně rozdělit na reakce anabolické a katabolické.
Anabolické reakce
- Jsou to reakce syntetické, skladné, při kterých vznikají z látek jednodušších látky složitější. Vyžaduje se pro ně energie, která se v jejich průběhu spotřebovává – jedná se o reakce endergonní.
- Mezi zástupce anabolických metabolických drah patří glukoneogeneze, syntéza glykogenu, mastných kyselin, triacylglycerolů – lipogeneze, aminokyselin, proteinů, ketolátek, tvorba močoviny a jiné.
Katabolické reakce
- Jde o reakce štěpné, degradační neboli rozkladné, při kterých se složitější látky štěpí na jednodušší. Dochází k uvolnění energie (exergonní reakce), která je využitelná pro tvorbu makroergních sloučenin.
- Katabolickými metabolickými drahami jsou například glykolýza, glykogenolýza, lipolýza, beta-oxidace, odbourávání ketolátek, degradace proteinů a aminokyselin.
- Reakce, které mají současně charakter drah anabolických i katabolických, označujeme jako amfibolické (řec. amfi – na obě strany).
- Například citrátový cyklus, ve kterém se dokončuje oxidace uhlíkaté kostry všech živin, je dráha katabolická. Tyto intermediáty zároveň slouží jako substráty pro dráhy anabolické, např. z alfa-ketoglutarátu se tvoří glutamát, ze sukcinyl-CoA hem nebo z citrátu mastné kyseliny. Reakce anaplerotické (řec. aná – nahoru a plerotikos – naplnit) slouží k doplnění meziproduktů metabolických drah. V citrátovém cyklu tyto reakce doplňují zejména oxalacetát (z glukózy, laktátu nebo glukogenních aminokyselin) a alfa-ketoglutarát – z glutamátu.)
Energetický metabolismus
Pro život je nutná kontinuální regenerace makroergních sloučenin. Slouží jako zdroj volné energie pro průběh endergonních reakcí. Jejich tvorba začíná rozkladem vysokomolekulárních látek. Ty se pak mění na základní meziprodukty, jako Acetyl-CoA. Dále se oxidují při aerobním metabolismu v citrátovém cyklu a vzniklé redukované koenzymy (NADH + H+ a FADH2) se využívají v dýchacím řetězci k tvorbě ATP.
Makroergní sloučeniny
Makroergní sloučeniny jsou látky obsahující makroergní vazby, tedy takové vazby, které při svém rozštěpení uvolňují velké množství energie.
ATP
ATP je hlavní a univerzální makroergní sloučenina. Zajišťuje částečné uskladnění, ale zejména přenos volné energie (G) v buňce. Kromě ATP existují i jiné makroergní sloučeniny, které jsou schopné štěpením uvolnit větší množství energie. ATP se využívá nejvíce. Podílí se na tom relativní stabilita anhydridové vazby, která odolává spontánní hydrolýze, na rozdíl od ostatních anhydridů, a štěpí se jen v přítomnosti enzymů.
K regeneraci ATP je pak možné využít látek s negativnějšími hodnotami volné energie, např. fosfoenolpyruvát, kreatinfosfát, 1,3-bisfosfoglycerát.
Vznik ATP
ATP může v buňce vznikat:
- Fosforylací na substrátové úrovni. Jedná se o energetické spřažení exergonní reakce se syntézou ATP z ADP a Pi. Nejčastěji se popisují tři reakce: dvě jsou součástí glykolýzy (přeměna fosfoenolpyruvátu na pyruvát a 1,3-bisfosfoglycerátu na 3-fosfoglycerát), jedna je součástí Krebsova cyklu (přeměna sukcinyl-CoA na sukcinát).
- Aerobní fosforylace a dýchací řetězec.
Podrobnější informace naleznete na stránce Dýchací řetězec a tvorba ATP .
Uvolnění energie z ATP
Hydrolýza ATP probíhá v několika krocích:
- ATP → ADP + Pi (ΔG = −30,5 kJ/mol);
- V ADP se nachází ještě jedna makroergní vazba, která může být využita. Protože je ale použití ADP místo ATP problematické kvůli substrátové specificitě enzymů, obvykle proběhne za katalýzy adenylátkinázou reakce:
- 2 ADP → ATP + AMP
- a využívá se vytvořené ATP.
- ATP → ADP + Pi (ΔG = −30,5 kJ/mol);
Z ATP se účinkem některých enzymů přímo uvolňuje difosfát (pyrofosfát, PPi):
- ATP → AMP + PPi (ΔG = −45,6 kJ/mol).
PPi je možné za uvolnění energie dále štěpit enzymem difosfatázou (pyrofosfatázou).
Jiné makroergní sloučeniny
- Ostatní nukleosidtrifosfáty jsou méně univerzální a používají se pro specifické účely. Např. UTP slouží k aktivaci sacharidů pro jejich vstup do metabolických drah.
- Enolfosfáty obsahují skupinu −OH, jež se estericky váže na fosfát. Nejdůležitější představitel, fosfoenolpyruvát (PEP), je makroergní sloučeninou s energeticky největším potenciálem ΔG (až −61,9 kJ/mol). Proto je také reakce přeměny PEP na pyruvát nevratnou reakcí glykolýzy.
- Acylfosfáty obsahují anhydridovou vazbu −COOH s fosfátem. Řadí se k nim karbamoylfosfát (využívaný při syntéze močoviny) nebo 1,3-bisfosfoglycerát (meziprodukt glykolýzy).
- Mezi další makroergní sloučeniny patří guanidinfosfáty (např. kreatinfosfát) nebo thioestery a thioétery (deriváty HS-CoA, SAM). Někdy se můžeme setkat s pojmem nízkoenergetické fosfáty. Podle klasické definice je makroergní sloučenina taková, která dokáže po zániku vazby uvolnit energii minimálně 25 kJ/mol. Mezi nízkoenergetické fosfáty patří například glukóza-6-fosfát a uvolňují méně energie, mezi 9 až 20 kJ/mol.
Hlavní meziprodukty energetického metabolismu
V buňkách existují metabolické dráhy – jakési křižovatky vzájemné přeměny živin. Patří sem pyruvátdehydrogenázová reakce (PDH), Krebsův cyklus (KC) a dýchací řetězec (DŘ). Tři meziprodukty, acetyl-CoA, pyruvát a NADH, mají významné postavení v energetickém metabolismu.
Acetyl-CoA
Tvorba
- Pyruvátdehydrogenázová reakce (PDH)
- Nevratnost této reakce je příčinou toho, že z naprosté většiny mastných kyselin se nedá vytvořit glukóza.
- Degradace aminokyselin
- Přímo na acetyl-CoA se degraduje lysin a leucin, ostatní aminokyseliny se přeměňují přes pyruvát.
- β-oxidace mastných kyselin a degradace ketolátek.
Využití
- Krebsův cyklus, na který navazuje dýchací řetězec (a tvorba ATP).
- Syntéza mastných kyselin a ketolátek (při nadbytku acetyl-CoA).
- Syntéza cholesterolu.
Pyruvát
Tvorba
- Aerobní glykolýza.
- Oxidace laktátu (za katalýzy laktátdehydrogenázou).
- Degradace některých AK.
Využití
- Syntéza acetyl-CoA (PDH).
- Syntéza laktátu – probíhá při anaerobní glykolýze, jejímž účelem je regenerace redukovaných koenzymů NADH + H+ zpět na NAD+.
- Syntéza alaninu (za katalýzy alaninaminotranferázou).
- Syntéza oxalacetátu (za katalýzy pyruvátkarboxylázou).
- Glukoneogeneze.
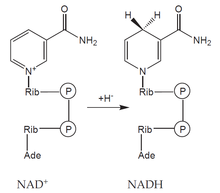
NADH
Tvorba
- Aerobní glykolýza
- Pyruvátdehydrogenázová reakce.
- Beta-oxidace mastných kyselin.
- Krebsův cyklus.
- Oxidace etanolu a laktátu.
Využití
- Dýchací řetězec a tvorba ATP.
- Přeměna pyruvátu na laktát.
Postavení orgánů v energetickém metabolismu
Játra
- Jaterní buňky (hepatocyty) mají zásadní roli při udržení homeostázy, při syntéze molekul, při vzájemné přeměně živin i při regulaci skladování a uvolňování energie. Účastní se metabolismu všech živin.
Metabolismus sacharidů
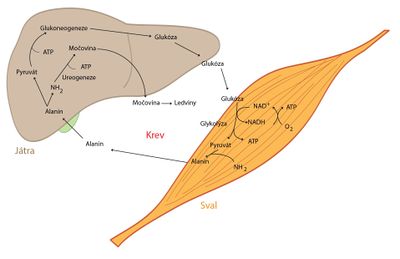
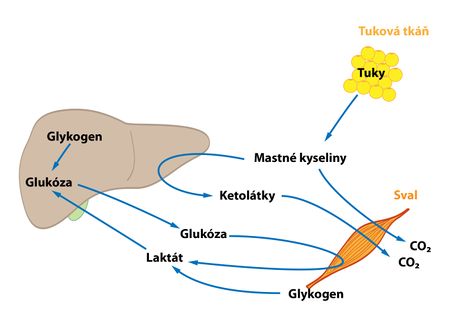
- V metabolismu sacharidů je důležitá jejich funkce krátkodobé, v rozsahu hodin, i dlouhodobé, v rozsahu dnů až týdnů, regulace glykémie – glukostatická funkce jater. Při vysoké hladině glukózy ve vena portae po jídle se v játrech nastartuje syntéza glykogenu, která spotřebovává glukózu vychytanou z krve. Naopak při lačnění a poklesu glykémie se glukóza doplňuje do oběhu prostřednictvím glykogenolýzy – rozkladu zásobního glykogenu, případně, když jsou zásoby glykogenu vyčerpány, glukoneogeneze.
Metabolismus lipidů
- Některé dráhy metabolismu lipidů jsou pro játra unikátní – syntéza ketolátek. Většina drah probíhá i jinde, ale v játrech jsou kvantitativně nejvýznamnější. Dochází zde k oxidaci mastných kyselin. Při hladovění probíhá tato dráha v rozsahu větším, než játra potřebují k produkci energie pro vlastní spotřebu. Ze vzniklého acetyl-CoA se následně tvoří ketolátky, které játra sama zpracovat neumí, a tak je uvolňují do oběhu, kde slouží jako alternativní zdroj energie. V játrech probíhá také syntéza cholesterolu.
- Klíčové je i postavení jater v metabolismu lipoproteinů:
- Syntetizují VLDL, část HDL;
- konvertují IDL na LDL;
- degradují chylomikronové zbytky, HDL a část LDL.
Metabolismus proteinů a aminokyselin
- V metabolismu proteinů a aminokyselin jsou opět některé reakce pro játra specifické – syntéza močoviny. Jiné reakce, například deaminace a transaminace aminokyselin či syntéza neesenciálních aminokyselin, probíhají i v jiných orgánech. Játra také syntetizují (kromě imunoglobulinů) všechny plazmatické proteiny, např. albumin nebo koagulační faktory.
Ledviny
- Koncentrování moče a transport látek v ledvinách vyžaduje velké množství energie, proto je spotřeba ATP, zejména v kůře, vysoká.
- ATP se získává oxidativním metabolismem glukózy, laktátu, mastných kyselin a aminokyselin.
- Z metabolických drah tu probíhá také glukoneogeneze, zejména při hladovění. Jejím hlavním substrátem jsou uhlíkaté kostry aminokyselin – hlavně glutaminu. Amoniak získaný při reakcích se vylučuje přímo do moče, kde slouží jako pufr.
Kosterní svaly
- Kosterní svaly spotřebují při své činnosti velké množství energie. Regenerace ATP probíhá cestou aerobní i anaerobní glykolýzy, degradace mastných kyselin a také z kreatinfosfátu.
- Zásadní je role kosterního svalu v metabolismu aminokyselin, převážně větvených (valin, leucin a izoleucin). Jejich uhlíkaté kostry slouží k tvorbě energie a jejich aminoskupiny se využívají pro syntézu alaninu, glutaminu a glutamátu, jež uvolňuje kosterní sval ve velkém množství do oběhu. Z alaninu pak játra mohou regenerovat glukózu – tzv. alaninový cyklus.
Tuková tkáň
- Tuková tkáň je postprandiálně – tedy po jídle, kdy převažuje vliv inzulinu, využívána jako sklad triacylglycerolů. Ukládá jak lipidy přijaté v potravě, tak vytvořené játry. Při lačnění, kdy převažuje účinek glukagonu, dochází naopak k lipolýze – uvolnění volných mastných kyselin a glycerolu.
Mozek
- Glukóza je hlavní energetický substrát mozku, denní spotřeba činí 120 g. Při adaptovaném hladovění, které vzniká přibližně po 3 týdnech bez adekvátního přísunu energie, dokáže mozek krýt až 50 % energetické spotřeby oxidací ketolátek.