Dýchací řetězec a tvorba ATP (FBLT)
Náplň podkapitoly
- Úvod do problematiky dýchacího řetězce a tvorby ATP
- Mitochondriální elektronový transportní řetězec
Úvod do problematiky dýchacího řetězce a tvorby ATP
Oxidace je ztráta elektronů, případně zvýšení oxidačního čísla příslušného prvku. Odebrané elektrony musí skončit na jiném prvku, a proto je oxidace jedné látky vždy spojena s redukcí látky jiné. Slovo „oxidace“ pochází ze slova „oxid“, které označuje sloučeninu obsahující kyslík. Kyslík není pro průběh oxidace nezbytně nutný.
Kyslík je oxidační činidlo. Má vysokou tendenci přijímat elektrony. Afinita prvku k elektronům je vyjádřena hodnotou jeho elektronegativity. Elektronegativita kyslíku je jedna z nejvyšších mezi prvky, vyšší má už jenom fluor. Přesun elektronů na kyslík, včetně tvorby vazeb s kyslíkem, je proces termodynamicky výhodný, tzn. uvolňuje energii.
Organizmy žijící na Zemi našly způsob využití energie přenosem elektronů z méně elektronegativních prvků na kyslík. Naše buňky oxidují organické sloučeniny obsažené v potravě na CO2 a H2O za spotřeby kyslíku a produkce energie. Tento proces někdy nazýváme také spalování živin. Na rozdíl od hoření je transfer elektronů z organických molekul na kyslík v našich buňkách rozdělen do mnoha kroků. Většina uvolněné energie se tak nepřemění na teplo a světlo, ale ukládá se ve formě chemického potenciálu. Z didaktických důvodů můžeme oxidativní metabolismus rozdělit do dvou fází:
- Oxidace substrátu spojená s redukcí kofaktorů enzymů;
- Reoxidace redukovaných kofaktorů kyslíkem.
Odbourávání glukózy
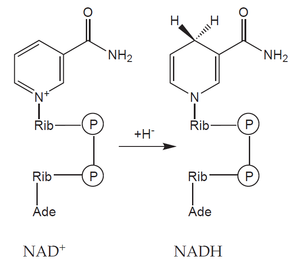
Jako příklad můžeme uvést glukózu. Její šestiuhlíkatá molekula (C6H12O6) je v procesu glykolýzy a pyruvátdehydrogenázové reakce postupně oxidována na dvě molekuly kyseliny octové (ve formě acetyl-koenzymu A) a dvě molekuly CO2. Během této reakce dochází k redukci čtyř molekul koenzymu NAD+ (nikotinamidadenindinukleotid) na NADH, přičemž každý přijme dva elektrony (často naznačeno jako přijetí hydridového aniontu H–).
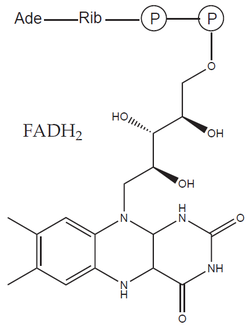
Vytvořený acetyl-CoA vstupuje do citrátového cyklu a je dále oxidován na dvě molekuly CO2 a čtyři molekuly redukovaných kofaktorů (tři NADH a jeden FADH2 – flavinadenindinukleotid). Ve výsledku dochází při oxidaci glukózy k tvorbě 12 redukovaných kofaktorů a šesti molekul CO2. V tomto procesu nedošlo ke spotřebě žádného molekulárního kyslíku (O2) – chybějící atomy kyslíku byly poskytnuty molekulami vody. V té se kyslík vyskytuje již v redukované formě (O–II), která se elektronového transferu neúčastní.
Aby mohla metabolická dráha fungovat, musí být redukované kofaktory zpětně reoxidovány. Proces reoxidace nastává nejčastěji v mitochondriích, kde redukované kofaktory předávají získané elektrony kyslíku (redukují ho). Redukce kyslíku pak vede k uvolnění značného množství energie.
Mitochondriální elektronový transportní řetězec
Mitochondrie jsou v buňce vázány na cytoskelet. Podle endosymbiotické teorie Lynn Margulisové se vyvinuly z aerobních bakterií, které byly předtím pohlceny fagocytujícími archebakteriemi. Část jejich genomu se přesunula do jádra „hostitelské“ buňky a tím se na ní staly závislé, zbytek genomu ale zůstal v mitochondriích. Kromě vlastních genů mají také vlastní proteosyntetický aparát vykazující znaky prokaryot (70S ribozomy), a proto bývají označovány jako semiautonomní organely.
Zevní mitochondriální membrána
Od vnějšího prostředí je odděluje podobná membráně endoplazmatického retikula. Tato membrána je poměrně dobře propustná pro většinu látek s menší molekulovou hmotností, ale zamezuje vstupu bílkovin a jiných makromolekul. Současně obsahuje:
- enzymy metabolismu mastných kyselin a fosfolipidů;
- tzv. TOM komplex (translocase of the outer membrane) přenášející proteiny z cytoplazmy do mezimembránového prostoru.
Mezimembránový prostor má složení podobné cytosolu (tzn. že obsah proteinů v něm je v porovnání s matrix nízký) a obsahuje například i cytochrom c a proapoptotické proteiny.
Vnitřní mitochondriální membrána
Membrána výrazně selektivní, polární molekuly přes ni téměř neprocházejí (s výjimkou několika, které mají vlastní transportéry).Vnitřní membrána obsahuje:
- fosfolipid kardiolipin;
- enzymy dýchacího řetězce;
- tzv. TIM komplex (translocase of the inner membrane) transportující určité proteiny.
Směrem do matrix vybíhá v podobě různých výběžků, nejčastěji krist a tubulů.
Mitochondriální matrix
Má podobu hustého proteinového gelu obsahujícího enzymy mnoha metabolických drah (Krebsova cyklu, β-oxidace MK, ornitinového cyklu a dalších). Dále se zde nachází mDNA (a příslušné tRNA a mRNA), ribozomy či anorganické ionty (jako Ca2+).
Elektronový transportní řetězec
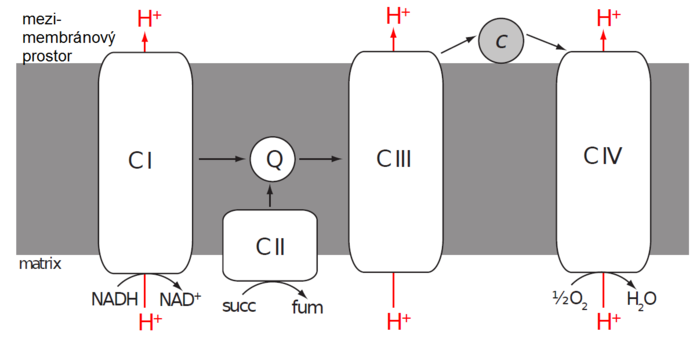
Redukované kofaktory přicházející z cytoplazmy (přes speciální transportní systém), a také z reakcí probíhajících v matrix, jsou reoxidovány na vnitřní mitochondriální membráně souborem enzymů nazývaných elektronový transportní řetězec (ETC – electron transfer chain). Ten se skládá ze čtyř enzymových komplexů označovaných jako Komplex I–IV.
Komplex I (NADH dehydrogenáza)
- Komplex I katalyzuje oxidaci NADH na NAD+ a zároveň transfer dvou elektronů na koenzym Q (CoQ) nazývaný též ubichinon. Přesná struktura mitochondriálního Komplexu I není úplně známá, ale víme, že obsahuje přes 40 podjednotek, jednu molekulu FMN a několik atomů železa v komplexech se sírou (FeS klastry, FeS clusters). Elektrony uvolněné z NADH se navážou na FMN a následně jeden po druhém přeskakují z jednoho FeS klastru na další, dokud nedorazí k ubichinonu a neredukují ho na ubichinol.
- Ubichinol (CoQH2 či UQH2) je tedy redukovaná forma ubichinonu (CoQ anebo UQ). Termín koenzym Q zahrnuje obě formy. Jedná se o extrémně hydrofobní molekulu, a to díky jeho dlouhému isoprenoidovému postrannímu řetězci, kterým je připojen na nepolární jádro vnitřní mitochondriální membrány. Zde CoQ funguje jako mobilní přenašeč elektronů z Komplexu I a II (případně jiných enzymů) na Komplex III.
Komplex II
- Komplex II katalyzuje oxidaci sukcinátu na fumarát a je integrální součástí citrátového cyklu (sukcinátdehydrogenáza). Elektrony získané oxidací jsou nejdříve transportovány na FAD vázané v enzymu a následně přes řetězec tří FeS klastrů a cytochrom b na ubichinon.
Komplex III (cytochrom c reduktáza)
- Komplex III přijme elektrony z redukovaného CoQ a předá je (přes dva cytochromy a FeS klaster) na další mobilní přenašeč elektronů – cytochrom c. Cytochrom c je malý hemoprotein připojený na vnější povrch vnitřní mitochondriální membrány. Na rozdíl od předchozích enzymů může jedna molekula cytochromu c přenášet jen jeden elektron. Dochází přitom k redukci železa hemu z ferri (III) na ferro (II) formu. Elektrony z ubichinolu jsou tedy jeden po druhém přeneseny komplexním procesem nazývaným Q-cyklus.
Komplex IV (cytochrom c oxidáza)
- Komplex IV, poslední člen ETC, převezme elektrony z redukovaného cytochromu c a přes dva cytochromy a tři atomy mědi je předává konečnému příjemci (akceptoru), kterým je kyslík.
Redoxní potenciál
Aby mitochondriální elektronový transportní řetězec (electron transport chain, ETC) mohl fungovat popsaným způsobem, musí existovat síla, která přes něj „tlačí” elektrony z NADH až na molekulární kyslík. V případě hořícího dřeva jsme mluvili o elektronegativitě elementárního kyslíku. Příbuzná míra afinity pro elektrony je redoxní potenciál.
V podkapitole Co pohání naše buňky jsme popisovali elektrodový potenciál vytvořený ponořením tyčinky čistého kovu do roztoku jeho iontů (tedy jeho oxidované formy). Pokud oddělíme dvě poloreakce přítomné v každé redoxní reakci (redukci a oxidaci), můžeme pro ně za standardních podmínek definovat standardní elektrodové potenciály. V závislosti na směru těchto reakcí je nazýváme standardní oxidační a standardní redukční potenciál. Souhrnně mluvíme o redoxním potenciálu (obvykle popisuje reakci ve směru jejího typického průběhu).
Tok elektronů ve správném směru (tj. z NADH na kyslík přes komplexy a mobilní přenašeče elektronů) v ETC lze vysvětlit tím, že redoxní (konkrétněji redukční) potenciály všech „zastávek po cestě” se postupně zvyšují. To znamená, že při postupu řetězcem se jeho jednotlivé články stále snáze a snáze redukují. Kyslík, nacházející se na konci řetězce, se redukuje zdaleka nejsnadněji – jde o velmi dobré oxidační činidlo.
Energie
Výhodou použití kyslíku jako finálního akceptoru elektronů je množství energie, které se následně nabízí k dispozici. Také velký nárůst redukčního potenciálu mezi NADH (či FADH2) a kyslíkem a jemu odpovídající změna volné energie (ΔG) se nepromrhá. Použije se na pumpování protonů (H+) z matrix mitochondrie do mezimembránového prostoru.
Tok elektronů přes Komplexy I, III a IV je spojený s přečerpáním určitého množství protonů na jeden pár elektronů. Komplex II žádné protony nepřenáší. Protože je vnitřní mitochondriální membrána vysoce nepropustná pro protony, dochází na ní k tvorbě protonového gradientu (množství protonů je větší v mezimembránovém prostoru než v matrix). Vyšší koncentrace protonů znamená nižší pH a pozitivní elektrický potenciál. Mezimembránový prostor má proto kyselejší prostředí a je pozitivně nabitý vůči matrix. Membránový potenciál mitochondrie je obvykle vyjádřen jako napětí.
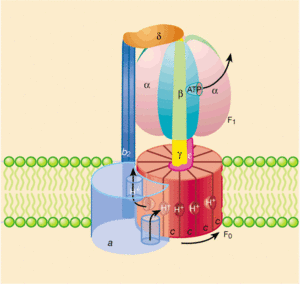
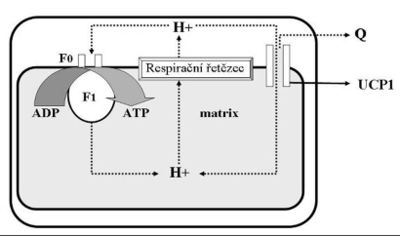
V mitochondrii se energie protonového gradientu na vnitřní membráně použije na výrobu jiného druhu energie – chemické energie uložené v molekulách ATP.
Syntéza ATP je katalyzována enzymem F1·F0-ATP syntáza. F0 podjednotka tvoří kanál přes vnitřní membránu mitochondrie, a umožňuje tak návrat protonů z mezimembránového prostoru zpět do matrix. Tok protonů po elektrochemickém gradientu se využívá k otáčení části enzymu. Rotace je následně přenášena na centrální osu (stopku) F1 podjednotky enzymu, která tlačí na vnější podjednotky. Ty jsou drženy nehybným spojením s periferní stopkou (osou), a tím je na nich poháněna fosforylace ADP na ATP. Podjednotka F1 má tři místa syntézy ATP, tudíž jedna kompletní otočka umožní tvorbu tří molekul ATP.
Specifický přenašeč (ANT – adenine nucleotide translocator) následně přenáší nově nasyntetizované molekuly ATP výměnou za ADP ven z matrix do cytoplazmy.
Stechiometrie
Všechny výše popisované procesy slouží primárně k tomu, aby se ze substrátu získala energie na užitečnou práci. Je proto pochopitelné, že nás zajímá, kolik energie mohou mitochondrie vytěžit například z molekul glukózy nebo kyseliny palmitové.
V předchozích částech jsme se zabývali množstvím elektronů (ve formě redukovaných kofaktorů) odebraných při metabolismu glukózy. Podobně můžeme jejich počet zjistit i pro jiné substráty. Otázka mitochondriální stechiometrie tedy zní: kolik molekul ATP můžeme vyrobit v ETC na určitý počet přenesených elektronů? Tuto otázku můžeme dále rozdělit na dvě podotázky:
- Kolik protonů je transportováno přes membránu na jeden pár elektronů? Na dva elektrony přeneseme deset protonů. Komplexy III a IV transportují dohromady šest protonů a komplex I přenese přibližně čtyři protony na elektronový pár.
- Kolik protonů se musí přemístit zpět do matrix, aby bylo možné vyrobit jednu molekulu ATP? Tady je odpověď o něco složitější. Podle dnešních modelů F1·F0-ATP syntázy je poměr H+/ATP přibližně 4,33. Znamená to, že pro výrobu tří molekul ATP je třeba přenést třináct protonů – deset přes F1·F0-ATP syntázu a další tři protony se použijí pro translokátor ANT na import ADP a fosfátu a na export ATP.
Uvedených čísel ovšem lze dosáhnout jen za optimálních podmínek, kdy všechny součásti ETC pracují bezchybně a vnitřní mitochondriální membrána je pro protony zcela nepropustná. Tyto podmínky samozřejmě nejsou obvyklé.
Rozpojení - uncoupling
Mechanismus převodu energie mezi ETC a syntézou ATP může být rozpojený, je-li umožněn zpětný tok protonů z mezimembránového prostoru do matrix. Tato neefektivní ztráta protonového gradientu promění v něm uloženou energii na její méně užitečnou formu – teplo.
Teplo je obecně mnohem méně užitečné než například ATP, ale existují situace, kdy schopnost produkovat teplo může zachránit život – například pokud je organismus vystaven nízkým teplotám.
Svalový třes je dobře známý mechanismus tvorby tepla, který využívají lidé i ostatní savci. Tento proces produkuje teplo prostřednictvím neefektivního převodu energie během svalové kontrakce. Novorozenci a mnoho zvířat používají jiný způsob – rozpojení mitochondriálního řetězce (uncoupling) = netřesová termogeneze.
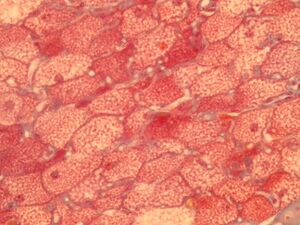
Rozpojení dýchacího řetězce k produkci tepla se odehrává převážně ve speciální tkáni zvané hnědá tuková tkáň.
Hnědý tuk:
- je takto zbarvený proto, že obsahuje mnoho mitochondrií,
- jeho úlohou je zjednodušeně energií "plýtvat".
Bílý tuk:
- energii skladuje.
Mitochondrie hnědé tukové tkáně obsahují speciální protein, který tvoří kanál ve vnitřní mitochondriální membráně, a umožňuje tak přesun elektronů – UCP-1 (uncoupling protein-1, thermogenin). Je-li hnědá tuková tkáň aktivována noradrenalinem (skrze β3-adrenergní receptory), hydrolyzuje své triacylglyceroly a uvolněné mastné kyseliny poskytují energii pro ETC a současně aktivují UCP-1.
Existují také jiné podtypy UCP (UCP-2 až UCP-5) exprimované v jiných tkáních, jejich funkce ale dosud není zcela objasněna.