Metabolismus aminokyselin
Náplň podkapitoly:
- Úvod do metabolismu proteinů a aminokyselin
- Degradace aminokyselin
- Degradace uhlíkatých skeletů aminokyselin
- Tvorba neesenciálních aminokyselin v lidském těle
- Významné deriváty jednotlivých aminokyselin
Úvod do metabolismu proteinů a aminokyselin
Proteiny patří mezi nejdůležitější a současně nejvíce zastoupené biomolekuly lidského těla. Souhrn všech aminokyselin v těle nazýváme aminokyselinový pool.
Tvorba a využití
Denně se u zdravého dospělého člověka degraduje asi 300–500 g proteinů na aminokyseliny. Hovoříme o tzv. proteolýze. Dalším zdrojem aminokyselin jsou proteiny obsažené v potravě, které představují přibližně 70–100 g za den. Posledním zdrojem aminokyselin je biosyntéza neesenciálních aminokyselin, kterou tělo získá denně 30–40 g aminokyselin.
Přibližně stejné množství aminokyselin, jako uvolňuje proteolýza, se zpětně inkorporuje do proteinů. Jedná se o proces tzv. proteosyntézy.
Degradujeme denně kolem 120 g aminokyselin – řetězec aminokyseliny se rozdělí na aminoskupinu (a ostatní atomy dusíku) a na uhlíkový řetězec – každý z nich má zcela odlišný osud.
Aminokyseliny mohou také sloužit jako prekurzory významných látek – např. biogenních aminů, hemu či purinů a pyrimidinů.
Poločas života proteinů se výrazně liší protein od proteinu, a proto nelze uvést průměrnou hodnotu. Obecně se ale dá říci, že strukturní proteiny jsou trvalejší – mají delší poločas. Molekuly mnoha enzymů naopak existují jen velmi krátce – jen několik desítek minut či hodin.
Proteolýza je kompletní degradace proteinů na volné aminokyseliny. V průběhu proteolýzy se uplatňují enzymy proteázy a peptidázy, které nacházíme jak v trávicím traktu, tak i v každé buňce – lyzosomy.
Základní dělení peptidáz rozlišuje:
- Exopeptidázy – amino- a karboxypeptidázy – štěpící proteiny / peptidy na koncích jejich řetězců;
- Endopeptidázy – trypsin, chymotrypsin či pepsin – štěpící vnitřní vazby proteinů / peptidů.
Ubikvitin-proteazomový systém
Ubikvitin je malý buněčný protein, který se vyskytuje ve všech eukaryotních buňkách. Slouží jako značka, která předurčuje protein k jeho degradaci v proteazomech. Tento proces nazýváme ubikvitinace (popřípadě polyubikvitinace – pokud je navázáno více molekul ubikvitinu).
Za objev rozkladu bílkovin iniciovaného ubikvitinem obdrželi v roce 2004 Nobelovu cenu za chemii („for the discovery of ubiquitin-mediated protein degradation”) Aaron Ciechanover, Avram Hershko a Irwin Rose.
Esenciální a postradatelné aminokyseliny
Aminokyseliny, které si naše tělo dovede samo syntetizovat nazýváme neesenciální, postradatelné.
Aminokyseliny, které musíme přijímat v potravě jsou esenciální, nepostradatelné.
- Esenciální aminokyseliny
- rozvětvené: Val, Leu, Ile;
- aromatické: Phe, Trp;
- bazické: Lys;
- obsahující síru: Met;
- s hydroxylovou skupinou: Thr.
- Podmíněně esenciální aminokyseliny
- Arg, His.
- Postradatelné aminokyseliny
- Gly, Ala, Ser, Pro, Cys, Tyr, Asn, Gln, Asp, Glu.
Důležité reakce aminokyselin
| Stránku je nutno sjednotit s jinou! | ||||
Tato stránka je tématicky totožná nebo velice podobná článku „Aminokyseliny“. Snažte se do něj její obsah včlenit, přesunuté části odmazat a nakonec na ní po úplném vyprázdnění vložením kódu #PŘESMĚRUJ [[Aminokyseliny]] vytvořit na doplněný článek přesměrování. | ||||
1) Dekarboxylace neboli odstranění karboxylové skupiny – vznik biogenních aminů;
2) Transaminace neboli výměna aminoskupiny s 2-oxokyselinou – vznik 2-oxokyseliny;
3) Oxidativní deaminace neboli oxidativní odstranění aminoskupiny – vznik 2-oxokyseliny;
4) Tvorba peptidové vazby – vznik peptidů a proteinů.
Základní shrnutí reakcí. Dole viz podrobný popis.
Defekty metabolismu aminokyselin
U člověka existuje mnoho různých genetických defektů metabolismu aminokyselin.
V případě mnoha z nich se v těle hromadí meziprodukty zapříčiňující defektní vývoj nervového systému, který často vyústí v mentální retardaci.
Degradace aminokyselin
Existuje 20 (21, pokud počítáme i selenocystein) základních proteinogenních aminokyselin, které mohou být v procesu translace vloženy do molekul proteinů. Katabolismus jejich uhlíkatých skeletů pokrývá přibližně 10–15 % energetických nároků našeho těla. Aminokyseliny také mohou sloužit jako substráty (prekurzory) pro biosyntézu ostatních živin – sacharidů (glukoneogeneze) a lipidů.
Odstranění aminoskupiny
- Odstranění aminoskupiny vnímáme jako klíčový krok katabolismu aminokyselin. Dusík z aminoskupin se nedá využít pro produkci energie a musí být z našeho těla odstraněn. To se děje jednak jeho přeměnou na močovinu (asi z 95 %), následně vyloučenou z organismu močí, jednak jeho uvolněním v tubulárních buňkách ledvin z glutaminu jako NH3/NH4+ (asi z 5 %).
Transaminace aminokyselin
- Transaminace jsou volně reverzibilní reakce katalyzované transaminázami (aminotransferázami). Během transaminace se vymění aminoskupina α-aminokyseliny s oxoskupinou 2-oxokyseliny – z aminokyseliny se vytváří 2-oxokyselina a z původní 2-oxokyseliny vzniká aminokyselina.
Aminoskupina je během reakce transportována ve vazbě na kofaktor pyridoxalfosfát (PLP, derivát vitaminu B6), který ji přenáší na oxokyselinu (tvorba Schiffovy báze).
Většina aminokyselin prochází při své degradaci transaminací. Jako konkrétní příklady transamináz si můžeme uvést aspartátaminotransferázu (AST) a alaninaminotransferázu (ALT), jež se běžně stanovují ke zjištění potenciálního poškození jaterních buněk.
- Vzniklé 2-oxokyseliny (oxaloacetát a pyruvát) se zapojují do energetického metabolismu buněk.
- Existují ale i výjimky, např. threonin, jež se při své degradaci vůbec přímo netransaminují.
Přeměna glutamát / glutamin
Přeměnu karboxylové skupiny glutamátu (v postranním řetězci) na amidovou skupinu glutaminu katalyzuje cytosolický enzym glutaminsyntetáza. K reakci je kromě enzymu potřeba ATP a NH4+. Tato reakce slouží v buňkách CNS jako hlavní detoxikační mechanismus odstraňující toxický NH3 z mozkové tkáně. Vznikající glutamin je nejvýznamnější transportní forma aminodusíku (amoniaku) v krvi – zajišťuje transport z extrahepatálních tkání krví do jater a ledvin. Má nejvyšší plazmatickou koncentraci ze všech aminokyselin – 0,6 mmol/l (alanin – 0,3 mmol/l). V jeho molekule „skladujeme” dvě aminoskupiny/amoniaky. Glutamin dovede vnášet amoniak do různých biosyntéz – např. do tvorby purinových bází.
Uvolnění NH3 z glutaminu katalyzuje mitochondriální enzym glutamináza (hydrolytická deaminace, hojně se vyskytuje v hepatocytech a buňkách tubulů ledvin). Vzniklý amoniak se v jaterních mitochondriích zapojuje do močovinového cyklu, v ledvinách je vyloučen do moči, kde slouží jako její pufr.
Oxidativní deaminace
Během oxidativní deaminace se za souběžného uvolnění NH3 aminoskupina přeměňuje na ketoskupinu. Glutamát je jediná aminokyselina, která se v lidském těle deaminuje dostatečnou rychlostí. Přeměnu katalyzuje glutamátdehydrogenáza uložená v matrix mitochondrie, hlavně jaterních buněk.
- Glutamát + NAD+ → α-ketoglutarát + NH4+ + NADH + H+
- Vzniklý NH4+ vstupuje do močovinového cyklu a α-ketoglutarát se může využít v transaminacích či v Krebsově cyklu. Uvedená reakce je plně reverzibilní – z α-KG a NH4+ můžeme nasyntetizovat glutamát.
Závěrem této části tedy můžeme konstatovat:
- že většina aminokyselin prochází při své degradaci transaminací;
- většina aminodusíku z aminokyselin se přímo či nepřímo nakonec koncentruje v molekule glutamátu/glutaminu.
- Z nich se následně uvolňuje v glutaminázové a glutamátdehydrogenázové reakci.
Močovinový (ornitinový) cyklus
Toxicita amoniaku
Amoniak volně prochází tělesnými bariérami, např. i hematoencefalickou bariérou. Při zvýšení jeho koncentrace v těle se vychýlí rovnováhy mnoha významných reakcí.
- Glutamát + NAD+ → α-ketoglutarát + NH4+
- Glutamát + NH4+ + ATP → glutamin + ADP + Pi
Při nadbytku amoniaku se tedy pomalu zvyšuje koncentrace glutaminu, jehož tvorba ale současně spotřebovává α-ketoglutarát z Krebsova cyklu – postupně klesá rychlost této významné dráhy a tím i produkce energie v buňkách. Plazmatická koncentrace amoniaku by neměla překročit hodnotu 35 μmol/l. V lidském těle se většina toxického amoniaku přeměňuje reakcemi močovinového cyklu na močovinu.
Reakce močovinového cyklu
Urea, netoxická sloučenina, je transportována krevním řečištěm do ledvin, kde se z organismu vyloučí močí. Močovinový cyklus lokalizovaný jak v matrix mitochondrie, tak v cytosolu jaterních buněk představuje energeticky náročný proces, do něhož vstupují tři substráty:
- amoniak;
- oxid uhličitý (bikarbonát);
- aspartát (jeho aminoskupina).
Regulačním enzymem je mitochondriální karbamoylfosfátsyntetáza I.
Ornitinový cyklus komunikuje s Krebsovým cyklem skrze oxalacetát a fumarát.
Tvorba močoviny probíhá během pěti reakcí:
- 1. Tvorba karbamoylfosfátu
- katalyzovaná mitochondriální karbamoylfosfátsyntázou I;
- NH4+ + HCO3– +2ATP → karbamoylfosfát + 2 ADP + Pi
- 2. Tvorba citrulinu
- katalyzovaná ornithintranskarbamoylázou;
- Ornitin + karbamoylfosfát → citrulin + Pi
- Citrulin je transportován do cytosolu.
- 3. Tvorba argininsukcinátu
- katalyzovaná argininsukcinátsyntetázou;
- Citrulin + Asp + ATP → argininsukcinát + AMP + PPi
- 4. Rozpad argininsukcinátu
- katalyzovaný argininsukcinátlyázou;
- Argininsukcinát → arginin + fumarát
- 5. Hydrolýza argininu
- katalyzovaná arginázou;
- Arginin + H2O → ornitin + močovina
Následuje přenos ornitinu do mitochondriální matrix.
Močovinový cyklus je těsně propojen s Krebsovým cyklem – ze vznikajícího fumarátu se stává aspartát. Fumarát se nejdříve hydratuje na malát, jehož oxidací vzniká oxalacetát. Ten je prostřednictvím enzymu aspartátaminotransferázy transaminován s glutamátem, čímž vzniká aspartát vstupující do ornitinového cyklu'. Glutamát se získává transaminací degradovaných aminokyselin, které předávají své aminoskupiny na molekuly α-ketoglutarátu.
Regulace ornitinového cyklu
Karbamoylfosfátsyntáza I je hlavní regulační enzym ornitinového cyklu. Je aktivována prostřednictvím N-acetylglutamátu, který vzniká reakcí Acetyl-CoA a glutamátu katalyzovanou N-acetylglutamátsyntetázou. Její aktivitu zvyšuje aminokyselina arginin.
Transkripce enzymů močovinového cyklu se zvyšuje u vysokoproteinové diety či u narůstajícího proteokatabolismu (např. za hladovění), tedy ve stavech zvýšené nabídky aminokyselin. Protože močovinový cyklus patří mezi protonproduktivní reakce, nastává jeho útlum při poklesu pH – acidóze.
Poruchy močovinového cyklu
- Hyperamonemie typu I – chybí enzym karbamoylsynthasa
- Hyperamonemie typu II – chybí enzym ornithintranskarbamoylasa
- Citrullinemie – chybí enzym argininsukcinátsynthasa
- Argininsukcinátrie – chybí enzym argininsukcinátlyasa
- Hyperargininemie – chybí enzym arginasa
Všechny uvedené poruchy jsou nesmírně vzácné, nicméně velmi závažné. Hyperamonemie jsou z uvedených poruch nejvažnější vzhledem k tomu, že v ostatních poruchách již část amoniaku byla kovalentně navázána na uhlíkový řetězec. Symptomy všech uvedených nemocí odpovídají intoxikaci amoniakem.
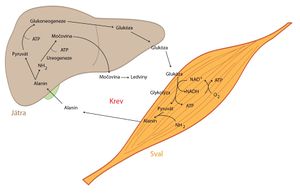
Glukóza-alaninový cyklus
Alanin se jednak spolupodílí na přenosu amoniaku krví, jednak slouží skrze pyruvát jako významný zdroj uhlíků pro proces glukoneogeneze.
Glukóza-alaninový cyklus je meziorgánová metabolická dráha probíhající mezi svalovými buňkami a játry.
- Poté, co pyruvát vznikne ve svalových buňkách, podléhá transaminaci za vzniku alaninu.
- Ten se uvolní do krve, která jej transportuje do jater, kde se transaminací zpětně přeměňuje na pyruvát, jenž se může zapojit do procesu glukoneogeneze.
- Vzniklá glukóza se krví dostává do svalů a celý cyklus se uzavírá.
Přenesená aminoskupina (amoniak) směřuje do močovinového cyklu.
Degradace uhlíkatých skeletů aminokyselin
Do lidských bílkovin se zabudovává kolem dvaceti aminokyselin (včetně selenocysteinu a pyrrolysinu jich je 22). Aminokyseliny, které se z jakéhokoli důvodu nevyužijí v metabolismu např. poté, co byly uvolněné z bílkovin, se nevyloučí v celku, ale katabolizují se na menší štěpy. Na počátku degradace se zpravidla odštěpí aminoskupina. Pak se odbourává zbývající uhlíkatý skelet. Dráhy, kterými se tak děje, jsou různě složité. Na tomto místě ukážeme společné mechanismy a uvedeme několik příkladů.
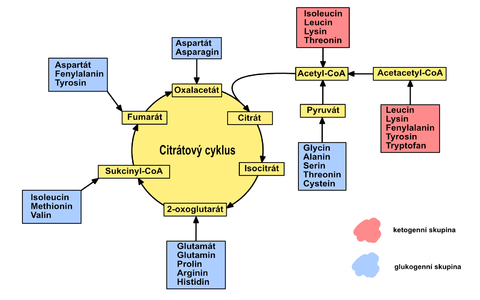
Odbourávání uhlíkatého skeletu všech aminokyselin končí některou z těchto sedmi látek:
- pyruvát,
- acetyl-CoA,
- acetoacetyl-CoA,
- α-ketoglutarát,
- sukcinyl-CoA,
- fumarát,
- oxalacetát.
Tyto produkty pak vstupují do energetického metabolismu. Mohou být buď dále oxidovány na oxid uhličitý a vodu v Krebsově cyklu, nebo se mohou přeměnit na jiná paliva. Z některých může vzniknout glukóza, z jiných jen ketolátky a mastné kyseliny. Podle toho rozlišujeme tzv. glukogenní a ketogenní aminokyseliny.
Mezi ketogenní aminokyseliny patří ty, které vedou k tvorbě acetyl-CoA a acetoacetyl-CoA – leucin a lysin (začínají na písmeno L).
Mezi glukogenní aminokyseiny řadíme ty, jež vedou k tvorbě zbylých pěti produktů – pyruvátu, α-ketoglutarátu, suc-CoA, fumarátu či oxalacetátu – serin, cystein, methionin, aspartát, glutamát, asparagin, glutamin, glycin, alanin, valin, prolin, histidin a arginin.
Existují i aminokyseliny se dvěma degradačními produkty – jeden z nich je glukogenní a druhý ketogenní. Nazýváme je keto- i glukogenní aminokyseliny – patří mezi ně isoleucin, fenylalanin, threonin, tyrosin a tryptofan.
Následující přehled zachycuje, jaké aminokyseliny se degradují na jaké produkty:
1) Acetyl-CoA a acetoacetyl-CoA
- čistě ketogenní jsou Lys a Leu, několik dalších aminokyselin poskytuje degradační produkty glukogenní i ketogenní – Phe, Tyr, Trp, Ile;
2) α-ketoglutarát
- pětiuhlíkaté aminokyseliny – Glu, Gln, Pro, Arg a His;
3) Suc-CoA
- nepolární aminokyseliny – Met, Ile a Val;
4) Fumarát
- Phe, Tyr;
5) Oxalacetát
- čtyřuhlíkaté aminokyseliny – Asp a Asn;
6) Pyruvát
- Cys, Ala, Ser, Gly, Thr, Trp.
Degradace větvených aminokyselin – Val, Leu a Ile
Pro tyto aminokyseliny je příznačné, že jsou degradovány nikoli v jaterních buňkách, ale převážně v extrahepatálních tkáních – vysoká aktivita zejména ve svalových buňkách. Ty obsahují specifickou transaminázu produkující příslušné α-ketokyseliny – tzv. ketoanaloga větvených aminokyselin. Tato transamináza absentuje v jaterních buňkách. Ketoanaloga se přeměňují na deriváty acyl-CoA působením dehydrogenačního komplexu, který katalyzuje oxidativní dekarboxylaci a dehydrogenaci.
Tvorba neesenciálních aminokyselin v lidském těle
V lidském těle nemůžeme syntetizovat esenciální aminokyseliny – Phe, Trp, Val, Leu, Ile, Met, Thr a Lys.
Dvě aminokyseliny jsou esenciální v období růstu organismu (období jejich zvýšené spotřeby), kdy rychlost jejich syntézy nestačí k pokrytí tělesných nároků – tzv. podmíněně esenciální aminokyseliny – Arg, His.
Ostatní aminokyseliny řadíme mezi neesenciální aminokyseliny.
Prekurzory aminokyselin:
1) Oxalacetát → Asp, Asn;
2) α-ketoglutarát → Glu, Gln, Pro, (Arg a His);
3) Pyruvát → Ala;
4) 3-fosfoglycerát → Ser, Cys a Gly;
5) Phe → Tyr.
Fenylketonurie (PKU)
Fenylketonurie je autozomálně recesivní onemocnění (výskyt 8–10 případů / 100 000 jedinců) podmíněné absencí či sníženou aktivitou fenylalaninhydroxylázy. Ta fyziologicky katalyzuje hydroxylaci Phe na Tyr. Při defektu enzymu dochází k alternativnímu odbourávání Phe – vzniká fenylpyruvát (transaminace), fenyllaktát, fenylacetát či fenylethylamin. Tyto látky se hromadí v tkáních a tělesných tekutinách a vyvolávají typický zápach moči po myšině. Některé z nich způsobují závažné poškození mozku.
Fenylketonurie byla prvním objeveným lidským genetickým defektem metabolismu aminokyselin a v současné době je jedním z onemocnění, u kterého se provádí screening u všech novorozenců. Pokud ji totiž dokážeme rozpoznat ještě v tomto věku, můžeme zabránit poškození mozku přísnou dietou s omezením Phe.
Významné deriváty jednotlivých aminokyselin
Dekarboxylace – tvorba biogenních aminů
Dekarboxylace je odstraňování karboxylové skupiny. Tomuto ději podléhají jen některé aminokyseliny.
Výsledkem je vznik tzv. biogenních aminů (monoaminů), které v lidském těle vykazují široké spektrum funkcí.
Základní přehled biogenních aminů:
1) Tyr → katecholaminy (DOPA → dopamin → noradrenalin → adrenalin)
2) Trp → serotonin (5-hydroxytryptamin)
3) Glu → γ-aminobutyrát (GABA)
4) His → histamin
5) Ser → etanolamin → cholin → acetylcholin
6) Cys → cysteamin
7) Asp → β-alanin
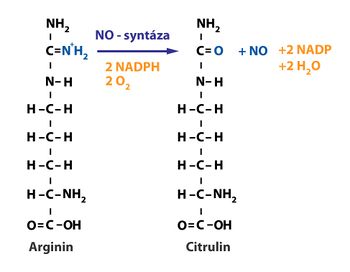
Oxid dusnatý (NO)
Oxid dusnatý je vazodilatační látka produkovaná endotelovými buňkami.
Tvoří se z L-argininu reakcí katalyzovanou NO-syntázou.
NO-syntáza se vyskytuje nejen v endotelových buňkách, ale i v některých buňkách imunitního systému a v některých neuronech. Je jednou z cytotoxických látek.
Další významné deriváty aminokyselin
Trp → melatonin
Phe a Tyr → hormony štítné žlázy, melanin
Gly → hem, puriny, kreatin, konjugace se žlučovými kyselinami
Arg a Ornitin → kreatin, polyaminy (spermidin, spermin)
Gly, Glu, Asp → puriny a pyrimidiny
Cys → taurin