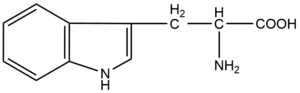
Tryptofan
Tryptofan paří mezi nepolární, esenciální, a navíc i aromatické aminokyseliny.
Metabolismus tryptofanu[upravit | editovat zdroj]
Tryptofan je aminokyselina, u které kynurenin-antranilátová cesta značí hlavní metabolický pochod. V prvním kroku se rozštěpí pětičlenný heterocyklus (pyrrol), poté se zkracuje postranní řetězec a nakonec se štěpí benzenové jádro tak, aby došlo k linearizaci molekuly. Pyrrol se v úvodním kroku štěpí za přítomnosti enzymu tzv. tryptofanpyrrolasy (tryptofanoxygenasy, nebo také tryptofandioxygenasy, jedná se stále o tentýž enzym) za vzniku sloučeniny N-formylkynureninu. Tento enzym se vyskytuje v játrech a jeho indukce probíhá za pomoci glukokortikoidů a glukagonu.
V následující reakci vzniká kyselina mravenčí a kynurenin. Vzniklý kynurenin se může dále měnit za pomocí tří metabolických cest, z nichž hlavní cestou je ta, kde probíhá reakce katalyzována kynureninhydroxylasou za vzniku 3-hydroxykyrureninu. Tato metabolická cesta tryptofanu dále pokračuje přes 3-hydroxyanthranilát, kdy za pomoci enzymu kynureninasy vznikne další aminokyselina alanin. Významnou reakcí kynureninu je také transaminace na xanthurenát.
Benzenové jádro je rozštěpeno oxidásou v molekule 3-hydroxyanthranilátu za vzniku 2-amino-3-karboxymukonátsemialdehydu. Tento semialdehyd se přes další reakce mění na méně významný aminomukonát, α-ketoadipát a glutaryl-CoA. V následujícím kroku se molekula zkracuje až na konečný produkt, kterým je acetacetát. Semialdehyd kyseliny 2-aminomukonové se může neenzymaticky cyklizovat na kyselinu pikolinovou.
Tryptofan je důležitým prekurzorem přibližně až 50 % pyridinových nukleotidů v organismu, které se tvoří z 2-amino-3-karboxymukonátsemialdehydu. 2-amino-3-karboxymukonátsemialdehyd se spontánně cyklizuje na chinolinát (neenzymaticky). Chinolinát je pomocí enzymu chinolinátfosforibosyltransferasy navázán na ribonukleotid. Zároveň probíhá i jedna z nejdůležitějších reakcí aminokyselin – dekarboxylace, kde konečným produktem této reakce je nikotinamid. Kynureninhydroxylasa je enzym, který je inhibován estrogeny u žen, a proto jsou ženy náchylnější k pelagře, k onemocnění, jehož hlavním projevem je deficit niacinu.
Z kynureninu vzniká řada neurotransmiterů jako kyselina kynureová a její amin kynuramin a chinolinát. Chinolinát se řadí mezi agonisty některých glutamových (excitačních) receptorů a kynurenát je naopak jejich antagonistou.
Z tryptofanu vzniká také velice důležitý neurotransmiter – serotonin (5-hydroxytryptamin). Prvně proběhne hydroxylace tryptofanu za pomoci tryptofan-5-monooxygenasou a THB (tetrahydrobiopterinu) s následnou dekarboxylací. Serotonin v mozku působí prostřednictvím serotoninergních receptorů (5-HT receptory). Má vliv na kontrakci hladkých svalů v arteriolách a bronchiolech, způsobuje jejich vazodilataci. Dekarboxylací tryptofanu vzniká také tryptamin, jehož funkce zatím není objasněna. Je významný jako regulátor.
Významný neurotransmiter je taktéž melatonin. Melatonin navozuje spánek. Jedná se o N-acetyl-5-methoxytryptamin tvořený v epifýze a v retině. První reakce je N-acetylace, a pak následuje O-methylace. Melatonin se vyplavuje v cirkadiánní rytmu, což znamená, že k jeho uvolnění dochází v pravidelnou dobu a to převážně v noci.
Je známý taktéž tzv. karcinoid, což je malý nádorek vznikající v břišní dutině a patologicky dokáže produkovat serotonin. V moči se pak nachází zvýšená koncentrace 5-hydroxyindoloctové kyseliny, což je významný metabolit serotoninu.
Tryptofan se ve střevě nedokáže dostatečně vstřebat a tak je rozkládán střevními bakteriemi na indol, indolakrylovou nebo indolpyrohroznovou kyselinu. Tyto kyseliny se následně vylučující močí z organismu ven. Pokud se tyhle kyseliny vylučují močí, mluvíme o Hartnupově chorobě. Projevuje se především poruchou transportu neutrálních aminokyselin (včetně tryptofanu) přes kartáčový lem tenkého střeva a v renálních tubulech.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
Použitá literatura[upravit | editovat zdroj]
- MATOUŠ, Bohuslav, et al. Základy lékařské chemie a biochemie. 1. vydání. Praha : Galén, 2010. 540 s. ISBN 978-80-7262-702-8.