Odbourávání lipidů a metabolismus ketolátek
Náplň podkapitoly:
- Úvod do odbourávání lipidů a metabolismu ketolátek.
- Lipidy jako zdroj energie – degradace TAG v buňkách, β-oxidace mastných kyselin.
- Tvorba a využití ketolátek.
Úvod do odbourávání lipidů a metabolismu ketolátek
Triacylglyceroly (TAG) uchovávají velké množství chemické energie. Jako uložiště energie jsou velmi výhodné, protože 1 g bezvodého TAG skladuje šestkrát více energie než 1 g hydratovaného glykogenu. Kompletní oxidací 1 g TAG se získá přibližně 38 kJ, zatímco z 1 g sacharidů či proteinů jen 17 kJ. 70 kg vážící muž shromažďuje ve svých TAG přibližně 400 000 kJ – celková hmotnost TAG se pohybuje kolem 10,5 kg. Tyto zásoby by nám mohly umožnit přežít i několikatýdenní hladovění. Hlavním místem akumulace TAG je cytoplazma adipocytů.
Oxidace mastných kyselin
Jednotlivé typy oxidace mastných kyselin se označují řeckými písmeny, jež určují uhlíkový atom, na kterém probíhají reakce. Majoritní význam má β-oxidace probíhající v matrix mitochondrie. Na membránách endoplazmatického retikula se vyskytují enzymy katalyzující tzv. ω- a α-oxidaci.
Převedení mastných kyselin na glukozu
Živočichové nedovedou převést mastné kyseliny na glukózu. MK představují bohatý zdroj energie pro glukoneogenezi, ale z jejich uhlíkových atomů se netvoří glukóza (s výjimkou mastných kyselin s lichým počtem C). Acetyl-CoA totiž nelze převést ani na pyruvát, ani na oxalacetát – oba uhlíky se během průběhu Krebsova cyklu odštěpí jako CO2. Pyruvátdehydrogenázová reakce je nevratná. Pro zajímavost rostliny mají navíc další dva enzymy, které jim umožňují převést AcCoA na OAA, v tzv. glyoxylátovém cyklu.
Lipidy jako zdroj energie – degradace TAG v buňkách, β-oxidace mastných kyselin
Využití lipidů k produkci energie probíhá ve třech základních fázích:
- Mobilizace lipidů – hydrolýza TAG na MK a glycerol a jejich transport krví.
- Aktivace MK v cytosolu a jejich transport do matrix mitochondrií.
- β-oxidace – odbourávání MK na acetyl~CoA, jenž vstupuje do Krebsova cyklu, či se z něj tvoří ketolátky.
Mobilizace lipidů – lipolýza
Mobilizaci zásobních lipidů enzymaticky zajišťuje hormon-senzitivní lipáza (HSL). Ta katalyzuje reakci:
- TAG → 3 MK + glycerol
Uvolněné mastné kyseliny se vážou na sérový albumin, který je dopraví na místo určení (např. do jater). Glycerol se přenáší volně rozpuštěný v plazmě.
Regulace lipolýzy
Jak již název napovídá, enzym se nachází pod důslednou hormonální kontrolou. Jeho aktivitu podněcuje fosforylace jeho molekuly. Inzulin jako anabolický hormon vyvolává jeho inhibici, kontraregulační hormony (glukagon, katecholaminy) či hormony štítné žlázy ho naopak aktivují.
Využití glycerolu
Glycerol získaný hydrolýzou triacylglycerolů se zapojuje do energetického metabolismu skrze meziprodukty glykolýzy nebo glukoneogeneze. První krok učiní jeho fosforylace na glycerol-3-P pomocí glycerolkinázy. Následuje jeho dehydrogenace na dihydroxyaceton-P katalyzovaná glyceraldehyd-3-fosfátdehydrogenázou. Ten představuje meziprodukt glykolýzy/glukoneogeneze.
Průnik mastných kyselin do buněk
Způsob překonání buněčné membrány závisí na délce řetězce. Mastné kyseliny s krátkým řetězcem (↓12C) mohou pronikat prostou difuzí. Ty s delším řetězcem využívají v membráně různé transportní systémy umožňující jejich usnadněnou difuzi – např. FATP (fatty acid transport protein) či FAT/CD36 (fatty acid translocase).
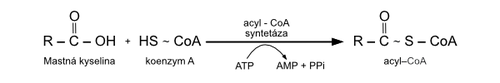
Aktivace mastných kyselin
K aktivaci mastných kyselin dochází v cytosolu, na vnější mitochondriální membráně, a to ihned po jejich vstupu do buňky. Bez aktivace totiž nelze vůbec uvažovat o zapojení jejich molekul do metabolismu. Aktivace pak současně udržuje jejich stálý koncentrační gradient (analogicky k fosforylaci glukózy – viz glykolýza). Principem aktivace mastných kyselin je esterové navázání molekuly mastné kyseliny na SH−skupinu koenzymu A prostřednictvím acyl−CoA−syntetázy (thiokináza mastných kyselin):
- MK + ATP + HS−CoA → acyl−CoA + AMP + 2 Pi
Aktivace mastné kyseliny probíhá ve skutečnosti ve dvou fázích. Nejdříve vzniká acyladenylát (acyl−AMP) a ve druhé fázi se AMP vyměňuje za koenzym A.
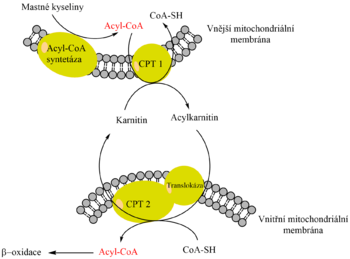
Vstup mastných kyselin do matrix mitochondrie
Způsob vstupu mastných kyselin do matrix mitochondrie závisí na délce jejich řetězce:
- do C10 vstupují do matrix volně;
- C12 až C18 vstupují pomocí karnitinového přenašeče;
- nad C18 neprocházejí.
Acyl-CoA s C12–C18 může volně procházet vnější mitochondriální membránou, ale vnitřní membrána je pro něj nepropustná. Mastná kyselina tedy musí opustit vazbu na koenzym A a navázat se na nového partnera. Tím je karnitin. Přenos mastné kyseliny mezi koenzymem A a karnitinem katalyzuje karnitinacyltransferáza I (CAT I neboli karnitinpalmitoyltransferáza I – CPT I) nacházející se na cytosolové straně vnější mitochondriální membrány.
Karnitin-acylkarnitin translokáza ve vnitřní mitochondriální membráně umožňuje následnou výměnu karnitinu za acylkarnitin, čímž se acylkarnitin dostává do matrix mitochondrie.
Zde dojde ke zpětnému přenosu mastné kyseliny z acylkarnitinu na koenzym A prostřednictvím karnitinacyltransferázy II (CAT II). Uvolněný karnitin opouští matrix pomocí translokázy výměnou za nový acylkarnitin. Tímto jsme přenesli acyl-CoA do matrix mitochondrie, kde podléhá β-oxidaci.
Beta oxidace mastných kyselin
β-oxidace probíhá pouze za aerobních podmínek – úzce totiž souvisí s dýchacím řetězcem. Jednotlivé reakce β-oxidace mastných kyselin katalyzují čtyři enzymy:
- Acyl~CoA−dehydrogenáza – prostetickou skupinou je FAD;
- Enoyl~CoA−hydratáza;
- L-3-hydroxyacyl~CoA-dehydrogenáza – koenzymem je NAD+;
- β-ketothioláza.
Reakce můžeme shrnout do sledu dehydrogenace – hydratace – dehydrogenace – thiolytické štěpení. První tři reakce jsou analogické k reakcím probíhajícím v Krebsově cyklu počínaje sukcinátem (viz Krebsův cyklus):
- Oxidace sukcinátu na fumarát pomocí sukcinátdehydrogenázy – kofaktorem je FAD.
- Adice vody na dvojnou vazbu ve fumarátu, vzniká malát za katalýzy fumaráthydratázou.
- Oxidace malátu na oxalacetát pomocí enzymu malátdehydrogenázy – kofaktorem je NAD+.
- 1. Acyl~CoA-dehydrogenáza – první oxidace
- Tento enzym katalyzuje vznik dvojné vazby mezi 2. (α) a 3. (β) uhlíkem řetězce mastné kyseliny. Jedná se o stereospecifickou reakci, při níž vzniká trans−enoyl−CoA. Příjemcem elektronů je FAD. V buňkách se vyskytují různé druhy dehydrogenáz, jež se liší délkou řetězce MK, kterou oxidují:
- krátké MK (4–6 C),
- střední MK (6–10 C),
- dlouhé MK (12–18 C).
- 2. Enoyl-CoA-hydratáza
- Tento enzym katalyzuje hydrataci trans- dvojné vazby vytvořené v prvním kroku. Vzniká hydroxylová skupina – L-3-hydroxyacyl-CoA.
- 3. Hydroxyacyl-CoA-dehydrogenáza
- Tento enzym katalyzuje oxidaci hydroxylové skupiny na třetím (β) uhlíku na ketoskupinu. Elektrony přijímá koenzym NAD+.
- 4. β-ketothioláza
- Posledním krokem jedné otočky β-oxidace je thiolytické štěpení katalyzované β-ketothiolázou. Dochází při něm k ataku SH−skupiny koenzymu na β-keto uhlík řetězce mastné kyseliny. Reakce vede ke vzniku AcCoA a o dva uhlíky kratší acyl~CoA.
Jedna otočka β-oxidace
β-oxidace je cyklický proces, jehož jednu otočku dokážeme zapsat jako:
Acyl−CoA + FAD + NAD+ + HS−CoA → acyl−CoA (o 2 C kratší) + FADH2 + NADH+H+ + AcCoA
Meziprodukt (acyl−CoA o 2 C kratší) vstupuje do dalšího kola β-oxidace. Většina mastných kyselin má sudý počet C, a proto se při poslední otočce přemění butyryl−CoA na dvě molekuly AcCoA.
Výtěžek kompletní oxidace palmitátu
Pro představu o celkové výtěžnosti oxidace mastných kyselin zde uvádíme rovnici a energetickou bilanci kompletní oxidace palmitátu:
Palmitoyl~CoA + 7 FAD + 7 NAD+ + 7 HSCoA + 7 H2O → 8 AcCoA + 7 FADH2 + 7 NADH+H+
Jak se lze dočíst ve článku o dýchacím řetězci a tvorbě ATP, nedokážeme zcela přesně určit množství ATP produkované v dýchacím řetězci při oxidaci živin. Proto následující čísla vnímejte prosím pouze jako přibližné a rámcově správné množství. Uvádíme je zde proto, abyste je mohli porovnat s oxidací jiných živin, např. glukózy. V dýchacím řetězci se získá z jednoho NADH 2,5 (3) ATP a z jednoho FADH2 1,5 (2) ATP, což při součtu představuje:
- 7 × FADH2 = 10, 5 (14) ATP,
- 7 × NADH = 17, 5 (21) ATP,
- Oxidace 8 AcCoA v Krebsově cyklu = 80 (96) ATP.
Celkový zisk se zastavil na součtu 108 (131) ATP. Na aktivaci mastné kyseliny jsme ale spotřebovali 2 ATP, a proto čistý zisk činí 106 (129) ATP.
Regulace beta-oxidace mastných kyselin
Regulace β-oxidace probíhá na úrovni vstupu mastných kyselin do mitochondrie – přesněji na úrovni karnitinového přenašeče karnitinacyltransferázy I (CAT I). Tento enzym je inhibován meziproduktem tvorby mastných kyselin – malonyl~CoA. Hovoříme o tzv. cross regulaci. Principem je syntéza mastných kyselin se odehrává v cytosolu, stejně jako reakce katalyzovaná CAT I. Malonyl~CoA vzniká jako produkt první reakce tvorby mastných kyselin. Cross regulace brání současnému průběhu syntézy i degradace MK. Inzulin β-oxidaci inhibuje, kontraregulační hormony ji naopak aktivují.
Mastné kyseliny s lichým počtem C
Oxidací mastných kyselin s lichým řetězcem se vytváří jako produkt kromě AcCoA i propionyl−CoA. Ten se nejdříve karboxyluje na methylmalonyl−CoA, který je převeden na sukcinyl−CoA – meziprodukt Krebsova cyklu. Skrze přeměnu na oxalacetát se může zapojit do glukoneogeneze – z těchto mastných kyselin se dá nasyntetizovat glukóza. Mastných kyselin s lichým počtem uhlíkových atomů se ale v těle vyskytuje velmi málo.
Odbourání nenasycených mastných kyselin
Většina nenasycených mastných kyselin v lidském těle a v potravě má cis konfiguraci dvojných vazeb. Jejich degradace v β-oxidaci probíhá procesem popsaným výše, dokud se jejich dvojná vazba nedostane do kontaktu s enoyl-CoA-hydratázou. Ta totiž vyžaduje jen trans izomery – je tedy nutné převedení cis izomeru na trans pomocí izomerázy.
Odbourání mastných kyselin s velmi dlouhým řetězcem
Oxidace mastných kyselin s velmi dlouhým řetězcem (více než 18 uhlíků) probíhá v peroxizomech. První krok katalyzuje flavoproteinová dehydrogenáza, která přenáší elektrony na O2 – vzniká H2O2:
- FADH2 z prvního kroku se reoxiduje nikoli v dýchacím řetězci, ale reakcí s O2: FADH2 + O2 → FAD + H2O2
- Peroxisomální kataláza rozkládá H2O2: 2 H2O2 → 2 H2O + O2
Oxidace končí u oktanoyl−CoA, který je z peroxizómů transportován ve vazbě na karnitin a míří do β-oxidace. Výše popsané reakce nevedou ke tvorbě ATP.
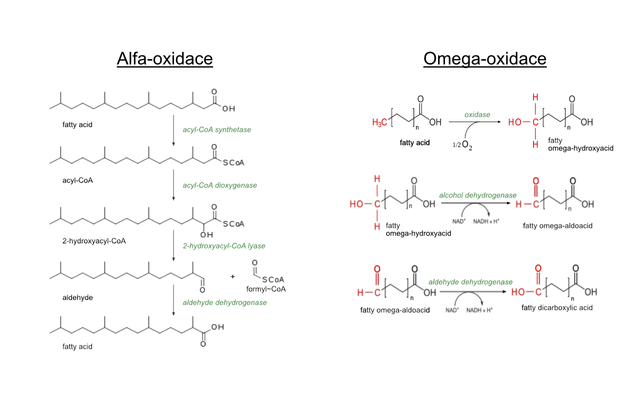
α-oxidace a ω-oxidace
Jedná se o minoritní dráhy oxidace mastných kyselin. Při ω-oxidaci dochází k reakcím na koncovém uhlíku řetězce. Při α-oxidaci nastává oxidace na α-uhlíku.
Omega oxidace probíhá v enoplasmatickém retikulu. Dochází k hydroxylaci koncové methylové skupiny, která je dále oxidována na karboxylovou. Vzniká dikarboxylová kyselina, kterou lze odbourat až na dikarboxylovou kyselinu se 6–10C. Ta už je dostatečně rozpustná ve vodě.
Tvorba a využití ketolátek
Tvorba a funkce ketolátek
Mezi ketolátky (ketone bodies) řadíme acetoacetát, β-hydroxybutyrát a aceton. Hlavním místem jejich tvorby jsou mitochondrie hepatocytů. Ketolátky představují ve vodě rozpustnou transportní formu acetylů. Tvoří se při nadbytku acetyl~CoA produkovaného jaterní beta-oxidací – játra „předžvýkají“ mastné kyseliny a poskytnou tělu ketolátky jako alternativní zdroj energie.
Vstup AcCoA do Krebsova cyklu závisí na dostupnosti oxaloacetátu (OAA). Ten vzniká karboxylací pyruvátu. Při hladovění či při diabetes mellitus se OAA spotřebovává v procesu glukoneogeneze. Nedostatek sacharidů vede ke snížení množství OAA a tím ke zpomalení Krebsova cyklu. Dalo by se říct, že "tuky hoří v ohni sacharidů".
Prostředí organismu
Dříve než se dostaneme ke konkrétním reakcím tvorby ketolátek – ketogenezi, popíšeme si situaci v organismu, za níž probíhá. Na počátku stojí aktivace lipolýzy prostřednictvím hormon-senzitivní lipázy (HSL). Po aktivaci lipolýzy se zvýší plazmatických koncentrací mastných kyselin, které ve zvýšené míře vstupují do jaterních buněk. V nich podléhají β-oxidaci, jež produkuje nadbytek AcCoA. Ten se nemůže dostatečně uplatnit v jiných drahách, a proto vstupuje do ketogeneze. Zdrojem uhlíkových atomů v ketogenezi je tedy pouze acetyl~CoA.
Průběh tvorby ketolátek
Průběh tvorby ketolátek můžeme popsat následujícími reakcemi:
- Kondenzace dvou molekul AcCoA → acetoacetyl~CoA.
- Reakce s dalším AcCoA → 3-hydroxy-3-methylglutaryl~CoA (HMG~CoA).
- Štěpení HMG~CoA → AcCoA a acetoacetát.
- Reverzibilní přeměna acetoacetátu a β-hydroxybutyrátu.
- Dekarboxylace acetoacetátu.
β-Ketothioláza
β-Ketothioláza katalyzuje poslední krok β-oxidace mastných kyselin – thiolytické štěpení. Při tvorbě ketolátek se reakce obrátí a ze dvou molekul AcCoA vzniká jedna molekula acetoacetyl~CoA. Reakce probíhá v matrix mitochondrie.
3-hydroxy-3-methylglutaryl-CoA syntáza
Tento enzym katalyzuje kondenzaci acetyl~CoA s acetoacetyl~CoA. Kondenzace probíhá na třetím uhlíku acetoacetyl~CoA za vzniku 3-hydroxy-3-methylglutaryl-CoA. Tento významný intermediát se vyskytuje nejen v metabolismu ketolátek, ale vzniká i během syntézy cholesterolu.
3-hydroxy-3-methylglutaryl-CoA lyáza
Tento enzym katalyzuje štěpení HMG-CoA na acetoacetát a AcCoA. Tím vzniká první ketolátka.
β-hydroxybutyrátdehydrogenáza
Tento enzym katalyzuje vzájemnou reverzibilní přeměnu dvou ketolátek – acetoacetátu a β-hydroxybutyrátu. Kofaktorem je NAD+. Při masivní tvorbě ketolátek je β-hydroxybutyrát kvantitativně nejvýznamnější ketolátkou v krvi, tj. většina acetoacetátu se přeměňuje na něj.
Dekarboxylace acetoacetátu
Část molekul acetoacetátu spontánně tj. neenzymově dekarboxyluje na aceton, který nemá v lidském těle žádné využití a je vylučován dýcháním či močí.
Aktivace a utilizace ketolátek
Ketolátky jsou produktem rozkladu mastných kyselin za určitých metabolických podmínek (např. hladovění). Mezi ketolátky patří acetacetát, beta-hydroxybutyrát a aceton. Vznikají pouze v játrech a jsou využívány extrahepatálními tkáněmi jako dočasný zdroj energie.
Chemické pochody
Ketolátky jsou polární a proto se transportují volně v plazmě. K jejich utilizaci dochází jen extrahepatálně, hepatocyty totiž neobsahují enzymy potřebné k jejich aktivaci. Nejdříve dochází k oxidaci β-hydroxybutyrátu na acetoacetát, který se následně aktivuje přenosem koenzymu A ze sukcinyl~CoA. Acetocetyl~CoA se přeměňuje na AcCoA (součást β-oxidace, katalyzuje thioláza), který vstupuje do Krebsova cyklu.
Využití ketolátek jednotlivými orgány
Srdeční sval, kosterní svalovina a kůra ledvin preferují oxidaci ketolátek před oxidací glukózy. Mozek se za hladovění adaptuje na spalování ketolátek – při dlouhodobém hladovění je až 50 % jeho energetických nároků kryto oxidací ketolátek.
Regulace ketogeneze
Regulace ketogeneze probíhá na čtyřech stupních:
- Hormon-senzitivní lipáza – lipolýza v tukové tkáni.
- Karnitinacyltransferáza I – vstup mastných kyselin do mitochondrie, kde proběhne jejich β-oxidace.
- Směřování AcCoA z β-oxidace do ketogeneze a ne do Krebsova cyklu .
- Mitochondriální HMG-CoA-syntáza.
Vysoká hladina ketolátek v krvi signalizuje přítomnost velkého množství AcCoA. Jejím následkem je inhibice lipolýzy.
Koncentrace ketolátek v plazmě a ketoacidóza
Zde uvádíme přehled plazmatických koncentrací 3−hydroxybutyrátu (3−HB) za různých situací:
| Koncentrace 3−hydroxybutyrátu v plazmě | Koncentrace volných mastných kyselin v plazmě | |
|---|---|---|
| Po jídle | ~ 0,05 mmol/l | < 0,2 mmol/l |
| 12 hod lačnění | < 0,2 mmol/l | ~ 0,4 mmol/l |
| 21 dní hladovění | ~ 5 mmol/l | ~ 1,5 mmol/l |
| T1DM, rozvinutá ketoacidóza s pH = 7,0 | ~ 20 mmol/l | ~ 5 mmol/l |
Maximální rychlosti tvorby ketolátek se dosáhne při plazmatické koncentraci ~ 12 mmol/l.
Odkazy
Související články
Ketoacidóza
Diabetická ketoacidóza (DKA) je život ohrožující komplikací diabetu mellitu. Příčinou je absolutní nebo relativní deficit inzulinu. Vyskytuje se u 20–40 % nově diagnostikovaných diabetiků. Mortalita DKA je < 2 %. Dominujícími příznaky jsou dehydratace, metabolická acidóza a hyperglykemie. Stresové situace (nejčastěji infekční choroby, náhlé příhody břišní aj.) vedou ke zvýšení inzulinové rezistence. I když dochází k hyperglykemii, ke ketóze dochází jen tehdy, pokud nejsou dostatečně zvýšeny dávky inzulinu. V praxi je možno se poměrně často setkat s tak hrubou chybou, že při nechutenství a zvracení je dávkování inzulinu dokonce sníženo nebo dávka je zcela vynechána.
Patofyziologie
Inzulin je anabolický hormon, který vede k tvorbě glykogenu v játrech a umožňuje lipogenezi. Deficit inzulinu je způsoben nedostatečnou sekrecí či substitucí inzulinu (nově vzniklý DM I. typu, chybně vedená terapie, technický problém podání inzulinu). Nedostatek inzulinu vede k selhávání dodávky odpovídajícího množství glukózy do buněk (hlavně svalů a tukové tkáně) s následným buněčným hladověním. Tato situace iniciuje vzestup kontraregulačních hormonů – glukagonu, kortikosteroidů, katecholaminů a růstového hormonu ve snaze posílit energetické zdroje. Dochází tak paradoxně k dalšímu navýšení hyperglykemie, nastává vystupňování lipolýzy, proteolýzy, glykogenolýzy a glukoneogeneze. Pokud se překročí reabsorpční schopnost renálních tubulů (zpravidla glykemie > 10 mmol/l), dochází ke glykosurii, která indukuje osmotickou diurézu. Výsledkem je hyperosmolální (hyperglykemická) dehydratace. Ve většině buněk těla hypertonický stav při DKA zesiluje intracelulární dehydrataci s cílem uchovat intravaskulární volum. Mozkové buňky se na hyperosmolalitu adaptují zvýšením intracelulárních osmoticky aktivních solutů, idiogenních osmolů (tzv. osmoprotekce). Tyto osmoprotektivní molekuly pomáhají udržovat objem nervových buněk navzdory vysoké hyperosmolalitě. Rychlý pokles osmolality, ke kterému dochází při podávání nadbytku volné vody, může vyvolat otok mozku iniciálním pohybem vody a ne elektrolytů přes endotel mozkových kapilár do osmoticky adaptovaných mozkových buněk.
Nedostatek inzulinu je důvodem, proč glukóza nemůže být využita jako energetický substrát. Dochází k aktivaci lipolýzy, v plasmě a hepatocytech se zvyšuje hladina volných mastných kyselin. Mastné kyseliny jsou degradovány β-oxidací rychleji, než se vzniklý acetylkoenzym A může zařadit do Krebsova cyklu. Z nadbytku acetylkoenzymu A vznikají ketolátky (aceton, acetoacetát a 3-β-hydroxybutyrát). Ketolátky představují alternativní využitelný zdroj energie při absenci glukózy intracelulárně. Ketolátky jsou produktem lipolýzy i proteolýzy. Jejich nevýhodou je, že jsou kyselé povahy a vedou ke vzniku metabolické acidózy (MAC). 3-β-hydroxybutyrát není chemickou strukturou ketonem, ale v praxi je zahrnován mezi ketony.
- Chemicky
- acetyl-CoA → CoA + acetyl,
- acetyl + acetyl → acetoacetát (redukcí acetoacetátu vzniká 3-β-hydroxybutyrát),
- 3-β-hydroxybutyrát → aceton.
Tato metabolická situace se částečně kompenzuje prostřednictvím hyperventilace a hyperpnoe, která vede k poklesu pCO2 při již nízké hladině bikarbonátů. Manifestní hyperventilace – Kussmaulovo dýchání, je obrazem marné snahy organismu o respirační kompenzaci MAc. Kussmaulovo dýchání, zejména u nejmenších dětí je spojeno se vzrůstající svalovou prací a proto se DKA často spojuje i s laktátovou acidózou (k tomu přispívá i dehydratace s hypoperfuzí). Narůstající množství ketolátek a laktátu vede k prohloubení celkové MAc.
Intracelulárně uložené kalium se z důvodu acidózy vyplavuje z buněk. Dalším důvodem kaliového efluxu z buněk je negativní dusíková bilance při proteinovém katabolismu. Kalium se potom ztrácí cestou osmotické diurézy. Objemová deplece vede k sekundárnímu hyperaldosteronismu, který dále zesiluje exkreci kalia v ledvinách. Výsledkem je výrazná kaliová deplece, ačkoli sérové hladiny kalia tomu nemusí z počátku odpovídat. Deplece kalia může vést k paralytickému ileu. Ztráty tekutin vedou i k depleci dalších iontů – kalcia, fosfátu a magnesia.
Redukce cirkulujícího volumu způsobená osmotickou diurézou, hyperventilací a zvracením je maskována přesunem tekutin z intracelulárního prostoru do extracelulárního (tj. i intravaskulárně) a kožní turgor proto zůstává dlouho zachován. Při korekci ketoacidózy stoupají hladiny acetoacetátu a acetonu v poměru k β-hydroxybutyrátu, při zhoršení acidózy dochází k opačnému ději. Rutinní laboratorní testy na přítomnost ketolátek detekují pouze aceton a acetoacetát, ne β-hydroxybutyrát. Proto se při DKA zpočátku zdá, že ketolátky chybí a naopak detekované ketolátky mohou stoupat i při ústupu těžké acidózy. Z toho vyplývá, že větší objektivita je při využití β-hydroxybutyrátu pro určení závažnosti DKA.
Klinický obraz
Při prvozáchytu diabetu mellitu najdeme u dětí v anamnéze údaje o polyurii a polydipsii, které předcházely akutní dekompenzaci. Navzdory zvýšené chuti k jídlu dochází k váhovému úbytku. Děti mají nauzeu, zvracení, bolesti břicha, žízeň, slabost, pocit závratě. U malých dětí můžeme nacházet výrazně promočené pleny. V těchto případech může chybět polydipsie a polyurie snadno unikne pozornosti. U větších dětí můžeme nacházet nykturii nebo sekundární enurézu. Méně než 10 % dětí s DKA je přijato do nemocnice již v komatu, ale daleko vyšší procento má signifikantní poruchu vědomí. Diagnostika čerstvě zachyceného diabetu může být často chybná. Bolesti břicha vedou k podezření na appendicitis acuta či jiný typ NPB (někdy můžeme nacházet i obleněnou peristaltiku), hyperpnoe vede k úvaze o pneumonii nebo astmatu, polyurie vede k podezření na infekci močového traktu. Příznaky jako enuréza, polydipsie a zvýšená iritabilita jsou často hodnoceny jako psychosomatické obtíže. Po stránce oběhové nacházíme prodloužený kapilární návrat, chladnou periferii a nehmatné periferní pulzace. Krevní tlak však dlouho zůstává normální. Pravidlem bývá tachykardie. U již diagnostikovaných diabetiků se příznaky rozvíjí dříve. V anamnéze najdeme údaje o interkurentním onemocnění, chybném managementu podávání inzulinu, včetně non-compliance pacientů.
Diagnostika
V rámci fyzikálního vyšetření je třeba věnovat pozornost příznakům dehydratace, tj. posoudit vlhkost sliznic a kožní turgor (kožní turgor ovšem může být relativně dlouho zachován). V některých případech pacienti vykazují příznaky hypovolemického šoku. Charakteristický je acetonový zápach dechu a hyperpnoe (Kussmaulovo dýchání), které poukazují na ketoacidózu. Pacienti mohou mít poruchu vědomí v rozsahu somnolence až hlubokého komatu. Bolesti břicha s rigiditou břišní stěny (pseudoperitonitis diabetica) připomínají symptomatologii náhlé příhody břišní.
Hyperglykemie bez ketoacidózy s nálezem hyperpigmentace (acanthosis nigricans) na zadní straně krku vede k podezření na diabetes mellitus II. typu. V laboratoři prokazujeme hyperglykemii, ketonemii a ketonurii, zpravidla i glykosurii. MAc je definovaná jako pH < 7,3 a HCO3 < 15 mmol/l. Hodnocení glykemie glukometrem je akceptovatelné k posouzení změn glykemie během léčby, ale v úvodu je třeba provést vyšetření krevní glukózy z klasického venozního odběru.
Hyperosmolarita
Pravidelně nacházíme hyperosmolalitu. Sérová osmolalita je zvyšována i akumulací tzv. idiogenních osmolů při těžkém katabolickém stavu. Proto se méně výrazně zvyšuje hodnota kalkulované osmolality na rozdíl od osmolality změřené osmometrem. Kalkulovanou osmolalitu můžeme vypočítat dle vzorce:
- S-osmolalita = 2 × Na + glykemie + urea
- norma: 280–295 mosmol/kg
V rámci DKA je užitečné určit osmolární/osmotické okno (osmolal/osmotic gap, OG), které vyjadřuje rozdíl mezi přímo měřenou osmolalitou osmometrem a vypočítanou osmolalitou podle výše uvedeného vzorce.
- Osmotic gap v mmol/l = měřená − kalkulovaná osmolalita
- fyziologická hodnota osmotic gap je 4–12 mmol
OG vzniká tím, že osmometrem změříme i soluty, které nejsou započítány ve vzorci. Pokud plazma obsahuje významné množství těchto nezapočítaných osmoticky aktivních látek (idiogenní osmoly při DM ketoacidóze) vznikne velký rozdíl mezi měřenou a počítanou hodnotou osmolality. Hodnota osmotic gap při DKA významně stoupá a je odrazem stupně katabolismu, naopak postupná úprava svědčí o úspěšné léčbě ketoacidózy.
MAC v rámci DKA
Klinickým korelátem jsou již výše zmiňované Kussmaulovo dýchání, acetonový zápach dechu a malinově červené sliznice. Pro DKA je typická akumulace ketokyselin (β-hydroxybutyrát a acetoacetát) a MAc je charakterizována vysokou hodnotou anion gap („aniontového okna“).
- anion gap (AG) = (Na + K) − (Cl + HCO3)
- fyziologická hodnota AG je 13–17 mmol/l
Hypoperfuze tkání při obecně závažném stavu a nadměrná dechová práce při Kussmaulově dýchání vede i k vzestupu laktátu a MAc je tak kombinací kumulace ketolátek a laktátu. Po metabolizaci akumulovaných aniontů – ketolátek, dochází k alkalizaci produkcí bikarbonátu v játrech, a proto acidózu korigujeme bikarbonátem jen při extrémně nízkých hodnotách pH. Vyšetření ABR provádíme většinou odběrem arterializované kapilární krve, které představuje jednodušší způsob, ale při dostupnosti arteriálního katetru jsou arteriální hodnoty jistě přesnější.
Pseudohyponatremie
Zpravidla nacházíme nižší hodnoty natremie („pseudohyponatremie“), neboť přítomná hyperglykemie má diluční efekt. Je třeba proto určit korigovanou natremii. Na cca 3 mmol/l glukózy nad referenční hodnotu připočítáme přibližně 1 mmol/l sodíku. Natremie má potom tendenci stoupat v rámci terapie ketoacidózy. Nedostatečný vzestup natremie, nebo dokonce pokles představuje zvýšené riziko edému mozku.
Natrium klesá o 1 mmol na každých 3 mmol zvýšení glykemie.
Hyperkalemie
Normokalemie nebo dokonce hyperkalemie je pravidelným nálezem u rozvinuté DKA, přestože hladina celkového kalia je snížena (viz patofyziologie). Při rehydrataci a substituci inzulinem je pacient ohrožen rychlým rozvojem hypokalemie, proto je substituce kaliem další prioritou v rámci terapie DKA. Existují algoritmy pro úhradu kalia s ohledem na jeho aktuální sérovou hladinu (viz terapie). Ztráty kalia se pohybují kolem 5 mmol/kg, u nejtěžších forem DKA až 10 mmol/kg!
Další laboratorní nálezy
Při určování laboratorních parametrů dehydratace má větší význam stanovení urey než kreatininu. Obvykle nacházíme výraznou leukocytózu bez vazby na infekční onemocnění. Mezi další typické laboratorní nálezy patří elevace sérových amyláz, která spolu s bolestmi břicha může vést ke špatně stanovené diagnóze pankreatitidy, elevace transamináz nebo kreatinkinázy. Hladiny fosfátů, kalcia a magnesia mohou být v počátku v referenčním rozmezí, ale velmi pravděpodobný je jejich výrazný deficit. Stav vědomí hodnotíme podle Glasgow coma scale (GCS). GCS < 12 b. hodnotíme jako poruchu vědomí. Pokles GCS během léčby je varující známkou rozvoje mozkového edému.
Diferenciální diagnostika
- Otrava methanolem,
- otrava ethanolem,
- otrava paraldehydem,
- otrava salicyláty,
- otrava metforminem,
- hladovění,
- uremie,
- diferenciální diagnostika laktátové MAC.
Terapie
(doporučení ISPAD k léčbě ketoacidózy[1])
Zajištění pacienta
Ideální je v úvodu zajistit 2 i.v. linky, kdy jedna slouží jako cesta k podávání rehydratačních roztoků a druhá k lineárnímu a přesnému dávkování inzulinu. Pacienti s těžkou poruchou vědomí, těžkou MAC nebo v šoku by měli mít zajištěnu i arteriální linku, zejm. z důvodu frekventních odběrů a vyšší validity vyšetření ABR. U dětí s poruchou vědomí je nezbytné i zavedení nazogastrické sondy. Močový katetr využíváme u všech dětí v těžké DKA. Umožňuje přesné stanovení diurézy s hodinovou bilancí. Je to důležité zejména v úvodu, neboť pacienti mohou i přes značnou dehydrataci ztrácet velký objem moče z důvodu osmotické diurézy. Přesná bilance diurézy umožní adekvátní rehydratační terapii. Intubaci a mechanickou ventilaci volíme jen v nejkrajnějším případě, při těžkém bezvědomí nebo mozkového edému. Nastavení režimu UPV je totiž velice obtížné z hlediska ventilačních parametrů, protože již drobná změna pCO2 hrozí významným posunem pH.
Volumexpanze a úprava deficitu tekutin
Na prvním místě je úprava volumu. Iniciálně podáváme 1/1 FR 20 ml/kg i.v. během hodiny. Dávku opakujeme, pokud neklesá pulsová frekvence a pokud se neupravuje kapilární návrat. Při šoku volíme iniciálně dávku 10–20 ml/kg i.v. během 20–30 minut. Po úpravě intravaskulárního volumu podáváme další tekutiny již opatrně. Pokud je kalkulovaná S-osmolalita < 320 mosmol/l můžeme deficit tekutin uhradit během 24 hodin. Pokud je však S-osmo > 345 mosmol/kg a korigovaná natremie > 145 mmol/l prodloužíme úhradu tekutiny na 48–72 hodin.
DKA je většinou spojena s průměrnou ztrátou tekutin představující cca 10 % hmotnosti. Závažnost dehydratace může být horší než klinický odhad, protože hyperosmolalita sera vede k přestupu intracelulární vody extracelulárně. Dále je třeba vzít v úvahu i průběžné ztráty polyurií, dokud není glykemie < 10 mmol/l.
Nesmírně důležité je současně hradit průběžné ztráty. Zvláště iniciálně přítomná polyurie navzdory dehydrataci může vést k neúspěchu naší rehydratační strategie. Proto neváháme se zavedením močového katetru a hodinovou bilancí tekutin. Z hlediska ztráty kalia můžeme na 1 litr moče počítat s 20 mmol draslíku. O adekvátnosti námi prováděné rehydratace nás výborně informuje kontrolní vážení pacienta, minimálně v intervalech 12 hodin. Další ztráta hmotnosti během infuzní terapie je vážným upozorněním na nedostatečně prováděnou rehydrataci.
Při poklesu glykémie < 15 mmol/l přecházíme na 5% glukózu s přídavkem námi vypočtených iontů. Tekutiny podáváme parenterálně do doby, než je dítě schopno přijímat per os.
Korekce iontů
Korekce natria
Obvykle zjišťujeme hyponatremii. Příčinou je jednak pseudohyponatremie při výrazné hyperglykemii, ale registrujeme i skutečnou ztrátu sodíku, která může představovat i 10 mmol/kg. Z praktického hlediska můžeme přejít na podávání 0,45 % roztoku NaCl po iniciální úpravě intravaskulárního volumu. Po zahájení volumexpanze očekáváme adekvátní vzestup natremie. Pokud je natremie < 135 mmol/l a i při adekvátní rehydrataci dále klesá a vyžaduje podávání výše koncentrovaných roztoků NaCl, je třeba zvažovat rozvoj SIADH při současném edému mozku.
V rámci úpravy natremie je třeba kalkulovat s tzv. efektivní osmolalitou a dále vzestup natremie během léčby posuzovat v korelaci s poklesem glykemie.
- Efektivní osmolalita (= S-tonicita) = 2 × (Na + glykemie)
Pozvolný pokles efektivní osmolality by měl nastat během léčby s postupným zvyšováním koncentrace Na v séru a současným poklesem hodnoty glykemie. Během léčby by se měla koncentrace natria v séru zvyšovat přibližně o 1–2 mmol/l s každým poklesem glykémie o 5–6 mmol/l. Takto korigovaná vypočtená hodnota sodíku by měla zůstat konstantní při každém současném stanovení glykemie a natremie během léčby. Pokud změřená koncentrace sodíku v séru bude vyšší, je třeba zhodnotit zvýšení potřeby volné vody, tedy zvýšení rychlosti podávaných tekutin. Pokud změřená natremie bude nižší a nebude stoupat při současném poklesu glykemie, je zřejmě příčinou nadměrné podání volné vody. Okamžitě musíme podávání volné vody snížit, tj. snížit rychlost podávání infuzí. Rychlý pokles efektivní osmolality vyvolaný nadměrným podáním volné vody může vést k edému mozku. Z tohoto hlediska je nebezpečný pokles osmolality séra o více než 3 mOsml/l/h.
Hypernatremie by měla být korigována až po korekci výrazné hyperglykemie a rychlost infuzí by měla být pomalejší, aby byl zajištěn patřičný, ale ne příliš rychlý, pokles hladiny natria. Může to být i déle než 48 hodin. Hypernatremii zpravidla korigujeme, pokud glykemie dosáhne hodnot < 20 mmol/l.
Korekce kalia
Všechny děti s DKA mají depleci kalia (průměrně 5 mmol/kg) a proto je náhrada kalia důležitou součástí léčby DKA. Jak již bylo řečeno, z důvodu těžké MAC můžeme zjišťovat normální nebo lehce zvýšenou hladinu sérového kalia i při těžké celkové depleci tohoto iontu. Po zahájení rehydratace a zejména v souvislosti s podáváním inzulinu dochází k rychlému přestupu kalia zpět do buněk a pacient je ohrožen hypokalemií. Kalium podáváme po korekci intravaskulárního volumu, při absenci hyperkalemie a jejího korelátu na EKG. Současně musí být přítomna diuréza. Dostatečná dodávka kalia je většinou zajištěna přidáním 40 mmol KCl do každého litru podávaných tekutin. Kalemii nutno korelovat s acidobazickou rovnováhou a EKG křivkou. Je-li kalium < 3,5 mmol/l a nedaří se jeho zvýšení, je vhodné přerušit terapii inzulinem, než hladina dosáhne adekvátního zvýšení.
Kalium hradíme jako kalium chlorid a kalium fosfát v poměru 2:1.
| sérová hodnota kalia | doporučené množství kalia do KI |
|---|---|
| < 3 mmol/l | 0,5–1 mmol kalia/kg i.v. během 1 hodiny + kontinuální monitorace EKG |
| 3 mmol/l | 40 mmol kalia do litru KI |
| 4 mmol/l | 30 mmol kalia do litru KI |
| 5 mmol/l | 20 mmol kalia do litru KI |
| 6 mmol/l | 10 mmol kalia do litru KI |
| > 6 mmol/l | přerušit infuzi kalia, kontrola kalemie s odstupem 2 hodin |
Korekce ostatních iontů
Hodnoty fosforu, kalcia a magnesia mohou být v referenčním rozmezí, ale velmi pravděpodobný je jejich výrazný deficit. Při těžké DKA zpravidla hradíme 1 mmol/kg uvedených iontů během 24 hod. Nepřiměřená léčba fosfáty může vést k hypokalcemii, na druhé straně podání fosfátů při výrazné hypofosfatemii snižuje svalovou slabost a depresi myokardu.
Korekce MAC
Nejdůležitějším krokem korekce MAC je adekvátní volumexpanze a inzulinová terapie. Podání bikarbonátu zůstává nadále kontroverzním, neboť vede k paradoxní acidóze v CNS a tím k depresi funkcí v CNS. Příčinou paradoxní acidózy je metabolismus bikarbonátu, kdy ve spojení s vodíkovými ionty (H+) dochází k tvorbě kyseliny uhličité (H2CO3).
Tato kyselina se ihned rozkládá na vodu (H2O) a oxid uhličitý (CO2). Hematoencefalická bariéra je více prostupná pro CO2 než pro HCO3-, a to vede k akumulaci CO2 v CNS a výsledkem je prohloubení acidózy v oblasti CNS. Léčba bikarbonátem je rezervována pro děti s pH < 7,0, HCO3 < 8 mmol/l, pro děti s v.s. kardiální depresí v souvislosti s MAC a pro ty, které již nejsou schopny dále kompenzovat MAC hyperventilací. Adekvátnost kompenzace můžeme stanovit, pokud známe hodnotu pCO2 a HCO3 dle tzv. Winterovy formule. Je-li pCO2 vyšší než výsledek vzorce: (1,5 × HCO3-) + 8, potom respirační úsilí již nestačí kompenzovat stupeň acidosy a podání bikarbonátu je opodstatněné. pH korigujeme na hodnotu pH 7,1–7,15 a HCO3 15 mmol/l.
při pH < 7,0 nebo HCO3 < 8 mmol/l podáváme bikarbonát v dávce: 0,1 × BE × kg t.h. korigujeme na pH 7,1–7,15, podáváme v KI, tj. NE jako bolus.
Léčba inzulinem
| O správnosti článku se vede diskuse. | ||||
| O obsahu článku „Odbourávání lipidů a metabolismus ketolátek“ se nyní debatuje. Více informací naleznete v diskusi. | ||||
Léčba inzulinem je nezbytná k zastavení tvorby ketolátek, což je primární příčinou DKA. Vedle substituce krystaloidy se podává inicální bolus inzulinu i.v. 8-12j humánního rychlého. Podávání inzulinu by mělo být zahájeno po stabilizaci oběhu (doplnění deficitu tekutin) a při dostatečné hodnotě kalemie ve vztahu k pH. Během prvních 60–90 minut rehydratační léčby klesá glykémie významně i bez podání inzulinu. Kontinuální podávání inzulinu tedy zahajujeme cca za 1 hod. po úvodní volumoterapii. Jak se ukázalo, dříve doporučované okamžité zahájení kontinuálního podávání inzulinu je spojeno s vyšším rizikem rozvoje edému mozku. Již vůbec není doporučován úvodní bolus inzulinu.
Užívá se humánní rekombinantní inzulin s rychlým účinkem, podáván nejlépe infuzní pumpou. Obvyklá iniciální dávka představuje 0,1 I.U./kg/hod., pro děti < 2 roky většina autorů doporučuje dávku poloviční, tj. 0,05 I.U./kg/hod.
Kalkulace infuze inzulinu :
Počet jednotek inzulinu = 5 I.U./kg do 50 ml 1/1FR, potom 1 ml/hod. = 0,1 I.U./kg/hod.
Před zahájením infuze je nutno infuzní set propláchnout 20 ml tohoto roztoku, neboť inzulin se váže na stěnu setu. V případě, že není možno podávat inzulin intravenózně, je možno rychle působící inzulin podávat intramuskulárně nebo podkožně v dávce 0,1 I.U./kg/hod. s dobrým efektem.
Glykemie má klesat pozvolna, tj. o 3–5 mmol/l/hod. (bezpečný je i pokles o 5–6 mmol/l/hod., pokud se současně zvyšuje natremie o 1–2 mmol/l/hod.). Není žádoucí pokles glykemie o více než 6 mmol/l/hod. Když glykémie klesne pod 15 mmol/l, je třeba začít podávat solné roztoky obsahující glukózu. Nejčastěji se doporučuje 5% glukóza s přídavkem natria na úrovni 1/2 FR + další potřebné ionty. Cílem je udržet glykémii 8–12 mmol/l. Nedojde-li do 2 hodin k poklesu glykemie, zvýšíme dávku inzulinu na 0,2 U.I./kg/hod. Pokud léčba inzulinem přesto nevede k poklesu glukózy, nutno zvažovat poruchu inzulinové pumpy, špatnou přípravu inzulinového roztoku, nedostatečnou hydrataci nebo závažné onemocnění probíhající současně s DKA (s excesivní hladinou kontraregulačních hormonů). Když glykemie stoupne během léčby > 15 mmol/l, doporučuje se zvýšit rychlost inzulinu o 25 %.
Pokud glykémie naopak klesá moc rychle nebo klesne pod 8 mmol/l při současně přítomné MAC, nesnižujeme rychlost inzulinu, ale navýšíme koncentraci glukózy na 10 %, ev. i více. Rychlost podávání inzulinu by měla být zpomalena pouze tehdy (maximálně na rychlost 0,05 I.U./kg/hod. – ještě nižší rychlost totiž hrozí opětovným návratem ketózy), když glykemie zůstává pod cílovou hranicí navzdory suplementaci glukózy.
Orální přívod tekutin by měl být zahájen až po výrazném zlepšení klinického stavu, i když mírná ketóza může ještě přetrvávat. Jakmile jsou orálně tekutiny tolerovány, je nutno redukovat přívod tekutin intravenózně. Podkožní podávání inzulinu je možno zahájit při toleranci p.o. přívodu a vymizení ketózy. Subkutánní dávka inzulinu s rychlým účinkem je obvykle podávána 10–30 minut před každým jídlem. I.v. dodávka inzulínu má pokračovat ještě asi 30–60 minut po podání první subkutánní dávky, což kontroluje glykemii, dokud nepůsobí dostatečně injekčně podaný inzulin.
Při glykemii < 10 mmol/l a pH > 7,35 možno přejít na s.c. podávání inzulinu.
Monitoring
Jednoznačnou indikací k přijetí na JIP u pacientů s DKA je věk < 1 rok, GCS < 12b., kalkulovaná S-osmolalita > 320 mosomol/l, natremie > 145 mmol/l a kalemie < 4 mmol/l.
Monitorujeme krevní tlak, srdeční a dechovou frekvenci, příjem a výdej tekutin (hodinové bilance). Pečlivě a pravidelně hodnotíme stav vědomí, reaktivitu a tvar zornic. EKG monitoring je potřebný pro riziko arytmií při hypo- nebo hyperkalemii. Glykemii kontrolujeme během prvních 2 hodin á 30 min., dále provádíme kontroly á 1 hod. po dobu podávání inzulinu i.v. Kalemii kontrolujeme každé 2–4 hodiny, dokud není normalizována acidóza a hyperglykemie. Frekventnější kontroly jsou požadovány, pokud je kalemie mimo fyziologické rozmezí nebo při podání bikarbonátu. Astrup provádíme iniciálně, dále v intervalech 2–4 hodin a vždy cca 30 min. po podání bikarbonátu. S ústupem acidózy a úpravou hydratace se lepší stav vědomí, ustupuje nauzea a zvracení.
| glykemie | během prvních 2 hodin kontrola á 30 min., dále kontroly á 1 hod. po dobu podávání inzulinu i.v. |
| kalium | kontrola á 2–4 hod., při patologických hodnotách á 1 hod. + kontinuální monitorace EKG (hlavně II. svod) |
| urea, natremie, S-osmolalita | kontroly v čase 0, 2, 6 hod. od počátku léčby |
| Astrup | á 2–4 hod. a vždy cca 30 min. po podání NaHCO3 |
Komplikace
Edém mozku
Nejzávažnější komplikací DKA je edém mozku (nejčastěji se rozvíjí v prvních 12–24 hodinách terapie). Přichází u cca 1 % pacientů s DKA. Příčina vzniku v rámci DKA není zcela objasněna. Na jeho vzniku participuje více faktorů: délka a závažnost DKA před započetím terapie, příliš agresivní volumexpanze, užití bikarbonátu, příliš rychlé podávání inzulinu, rozkolísání osmolality při prudkém poklesu Na, Cl, urey, cerebrální hypoxie a stupeň hyperglykemie.
Typické klinické známky rozvíjejícího se edému mozku zahrnují bolest hlavy, irritabilitu, zmatenost, poruchu vědomí, malé a anizokorické zornice, hypertenzi s bradykardií, pokles SaO2, parézy hlavových nervů, Cheyneův-Stokesův vzorec ventilace, příležitostně změny na očním pozadí (vymizení venózních pulzací, edém papil). Bohužel pouze 50 % dětí vykazuje prodromální příznaky edému mozku, velice nepříznivý je náhlý rozvoj křečí či zástava dechu.
Při podezření na edém mozku dítě vyžaduje resuscitační péči. Zprvu je nutno vyloučit hypoglykemii. Terapeuticky podáváme hypertonické roztoky natria (pokud není souběžně hypernatremie), zpomalujeme rychlost infuze na poloviční, zvážíme podání steroidů. Při hrozbě konu podáváme 20% mannitol 5 ml/kg během 20 minut, intubujeme a hyperventilujeme.
Po stabilizaci stavu je třeba provést zobrazení mozku pomocí CT či MRI, protože se mohou objevit i jiné příčiny zhoršení stavu – hemoragie, trombózy a infarkty. Edém mozku je nejvýznamnější příčinou smrti při DKA.
Další komplikace
Další častou komplikací při léčbě DKA je hypokalemie. Mezi vzácnější komplikace patří ARDS, rabdomyolýza, akutní selhání ledvin. Někteří pacienti mohou udávat rozmazané vidění, jehož příčinou je vzácná komplikace – luxace čočky z důvodu shiftu tekutin při objemové náhradě.
Diabetické hyperosmolární koma, DHK
Patofyziologie DHK
K rovnováze mezi kapacitou glukoneogeneze a glykosurií dochází při hodnotách glykemie 30–35 mmol/l, nález vyšších glykemií je vždy projevem těžké hyperosmolární dehydratace. V této situaci je extrémně vysoké riziko edému mozku při rehydratační terapii, často rovněž rozvoj SIADH. Jde o hyperosmolární diabetické koma s vysokou hodnotou glykemie > 40 mmol/l bez ketózy nebo jen s mírnou ketózou. Může vzniknout u dětí s malou reziduální kapacitou sekrece inzulinu a současně neschopností dosáhnout přiměřeného příjmu tekutin a při hyperosmolalitě v důsledku hyperglykemie.
Typicky se tento stav může objevit u velmi malých dětí nebo dětí mentálně postižených, u dětí léčených vysokými dávkami glukokortikoidů nebo léčených diazoxidem pro hypoglykemie. Měřená S-osmolalita může dosáhnout extrémních hodnot 360–380 mosmol/kg. Po zahájení rehydratační terapie se zvyšuje β-oxidace mastných kyselin a dochází paradoxně k prohloubení MAC.
Laboratorní kritéria
- Glykemie > 40 mmol/l,
- S-osmolalita > 345 mosmol/kg,
- korigované Na > 145 mmol/l.
Terapie
Deficit tekutin hradíme minimálně během 72 hodin. Iniciálně volíme dávky inzulinu nižší, tj 0,01–0,05 I.U./kg/hod. Zvýšení na obvyklých 0,1 I.U./kg/hod. indikujeme až při poklesu glykémie < 30 mmol/l. Při rozvoji SIADH redukujeme tekutiny o dalších 20–25 %. Je zde podstatně vyšší riziko edému mozku než u běžné DKA. Léčba edému mozku je popsána výše.
Infekce u pacientů s diabetes mellitus
Diabetes mellitus I. typu, zvláště při dlouhodobé hyperglykemii, se vyznačuje zvýšeným rizikem těžké bakteriální, virové nebo mykotické infekce. Bylo prokázáno, že hyperglykemie při záchytu nemoci nebo při nedostatečné kompenzaci diabetu je hlavní příčinou snížené imunoreaktivity.
Je alterována funkce polymorfonukleárů, snížená chemotaxe, adherence, baktericidní aktivita s defektní tvorbou peroxidu vodíku a NADPH. Snížena je i kožní reaktivita na T-antigeny. Po dosažení euglykemického stavu se přechodná porucha fagocytárních funkcí a buněčné imunity postupně upravuje k normě.
Staphylococcus aureus je z bakterií nejčastější příčinou kožních pyodermií (karbunkly, furunkly), podkožních abscesů, fasciitid, svalových abscesů, infekcí respiračního traktu (bronchopneumonie, pleuropneumonie, abscesy plic), infekcí urogenitálního systému (pyelonefritidy, absces ledvin, perinefritický absces). Z ostatních agens se mohou podílet na těžké infekční komplikaci Streptococcus pneumoniae, E. coli, Salmonella enteritidis, méně často Mycobacterium tuberculosis. Invazivní infekce zapříčiněná zlatým stafylokokem se šíří především hematogenně. Jako zdroj se často uvádí nasální kolonizace diabetiků zlatým stafylokokem. I zde se jako nežádoucí faktor, který zvyšuje procento osídlení, uplatňuje špatná kompenzace základního onemocnění s hodnotami glykosylovaného hemoglobinu > 9 %. Velkým rizikem bakteriální infekce je nedodržování zásad aseptické aplikace inzulinu.
Diagnóza diseminované stafylokokové infekce s tvorbou mnohočetných abscesů bývá v prvních dnech infekce velmi obtížná. Použití všech zobrazovacích metod (UZV, CT, MRI) je velmi přínosné. Při více ložiskovém procesu může ke správné diagnóze přispět i galiová scintigrafie.
Nedávno bylo zjištěno, že sníženou funkci polymorfonukleárů, která je považována za hlavní rizikový faktor invazivní stafylokokové infekce, je možné léčebně ovlivnit podáním rekombinantního růstového faktoru pro granulocyty rhG-CSF. Očkování proti pneumokokům a viru influenzy je podle některých léčebných algoritmů doporučováno pro všechny pacienty s diabetem.
- ↑ GLASER, Nicole, Maria FRITSCH a Leena PRIYAMBADA. ISPAD Clinical Practice Consensus Guidelines 2022: Diabetic ketoacidosis and hyperglycemic hyperosmolar state. Pediatric Diabetes. 2022, roč. 7, vol. 23, s. 835-856, ISSN 1399-543X. DOI: 10.1111/pedi.13406.