Fluorescenční spektroskopie
Základní charakteristika[upravit | editovat zdroj]
Fluorescence je jev, kdy molekula po excitaci elektromagnetickým zářením o vhodné vlnové délce při návratu do základního stavu vyzáří energii ve formě fotonu. Je možné měřit i slabý fluorescenční signál na pozadí intenzivního excitačního záření. Toho využívá fluorescenční spektroskopie, což je metoda stále více využívaná nejen v biofyzikálním a biochemickém výzkumu, ale i v biomedicíně.
Fluorescenční spektroskopie využívá závislosti emisních vlastností fluoroforu na prostředí, přenosu elektronové excitační energie mezi donorem a fluoreskujícím akceptorem a polarizované fluorescence. Nabízí pak vysokou selektivitu sbíraného materiálu a můžeme získávat informace o rozmístění, pohyblivosti a vlastnosti okolí jediného druhu molekuly přítomného ve složitých systémech.
Spektroskopie[upravit | editovat zdroj]
Spektroskopie se zabývá vznikem a vlastnostmi spekter. Je to metoda založená na vzájemném působení elektromagnetického záření a zkoumané látky, při kterém dochází k výměně energie (prosvítíme-li vzorek zářením o známé intenzitě, zjistíme, že intenzita prošlého světla je jiná – to je právě způsobeno interakcí záření se vzorkem). Zkoumaná látka může záření pohlcovat nebo vyzařovat, spektroskopie pak měří emise a absorpce různých vlnových délek viditelného i neviditelného záření. Je tedy často využívána ve fyzikální a analytické chemii k identifikaci substancí.
Samotné spektrum je závislost intenzity elektromagnetického záření prošlého vzorkem (popř. intenzity vyzářeného elektromagnetického záření) na vlnové délce, frekvenci nebo vlnočtu.
Spektroskopii lze rozdělit podle několika měřítek. Jedním může být typ interakce záření se vzorkem, jiným je pak použitá vlnová délka a typ záření.
Spektroskopické metody obecně[upravit | editovat zdroj]
- Ramanova spektroskopie je založena na měření spektra elektromagnetického záření rozptýleného díky Ramanově jevu. Pracuje s vibracemi molekul a používá rozptyl laserového paprsku při interakci s látkou.
- Spektroskopie ve viditelné a UV oblasti (UV/VIS) je klasická metoda analytické chemie, dnes už ne příliš využívaná.
- Infračervená spektroskopie se využívá k identifikaci a strukturní charakteristice organických látek. Je založena na principu absorpce infračerveného záření při průchodu vzorkem.
- Zeslabený úplný odraz (ATR) je modifikací infračervené spektroskopie.
- Atomová absorpční spektroskopie (AAS) je metoda sloužící ke stanovení obsahu stopových i významných koncentrací jednotlivých prvků v analyzovaném roztoku.
- Rentgenová fluorescence používá k excitaci rentgenové záření.
Spektroskop[upravit | editovat zdroj]
První spektroskop sestrojili r. 1860 Kirchhoff a Bunsen. Jeho základními součástmi byly trojboký hranol (tj. disperzní prvek), kollimátor (tj. trubice na jednom konci opatřená štěrbinou), analyzátor a stupnice.
Spektroskop je přístroj určený pro rozkládání viditelného světla na jednotlivé složky a pozorování spekter. Je založený na rozkladu světla hranolem (u hranolového spektroskopu) či mřížkou (u mřížkového spektroskopu). Používá se hlavně na kvalitativní spektrální analýzu látek.
Takový spektroskop, který zaznamenává spektrum na fotografické desce nebo jiným záznamovým zařízením, se nazývá spektrograf.
Pokud umožňuje měření frekvence spektrálních čar ve spektru (proměření spektra), jedná se o spektrometr.
Fluorescence[upravit | editovat zdroj]
Základní teorie fluorescence[upravit | editovat zdroj]
Molekula v základním stavu může absorbovat elektromagnetické záření, čímž dojde k excitaci atomu (tj. k přechodu elektronu z orbitalu o nižší energii do nejbližšího neobsazeného orbitalu o vyšší energii). Tato excitovaná molekula se pak zbavuje přebytečné energie několika způsoby – zářivými a nezářivými.
Pro naše účely jsou důležitější deaktivační procesy, při nichž dochází k vyzáření světelného kvanta. Fluorescence je deexcitačním procesem a je spinově povoleným zářivým přechodem, obvykle z rovnovážné vibrační hladiny stavu S1 do některé z vibračních hladin základního stavu S0.
Fluorescenci můžeme pozorovat zejména u organických látek (u anorganických je pozorována zřídka), nejčastěji využívané jsou pak sloučeniny obsahující aromatické cykly (látky schopné fluorescence pak nazýváme fluorofory nebo fluorescenční barviva).
Princip fluorescence tedy lze vysvětlit takto:
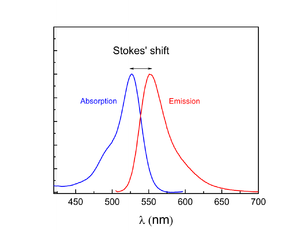
Fluorescence je vyvolána buď účinkem jiného dopadajícího záření, nebo účinkem dopadajících částic. Emise záření trvá krátkou dobu a po zhasnutí excitačního záření téměř okamžitě také ona zhasíná. Emisní záření je charakterizováno vyzářením energie ve velmi krátké době, řádově 10-9 s až 10-6 s. Elektrony v obalech fluoroforů jsou schopny absorbovat foton a tím zvýšit svou energii. Po chvíli však část této nové energie vyzáří opět ve formě fotonu, ale s nižší energií. Energie se totiž zbavují i tzv. nezářivými přechody, kdy se část energie dostává do nižších excitovaných stavů (postupně až na stav S1). Při přechodu ze stavu S1 do základního S0 jsou nezářivé přechody pomalejší a může zde již také docházet k fluorescenci. Díky nezářivým procesům u přechodů z vyšších excitovaných stavů do nižších dochází ke ztrátě energie, proto je frekvence následně emitovaného záření nižší a jeho vlnová délka tedy bude delší než vlnová délka záření excitačního.
Pro pochopení principu fluorescence nám může posloužit Bohrův model atomu.
Emisní a excitační centrum a pravidla fluorescence[upravit | editovat zdroj]
Emisní spektrum vyjadřuje závislost intenzity fluorescence na vlnové délce při konstantní vlnové délce budícího záření. Excitační spektrum vyjadřuje závislost intenzity fluorescence na vlnové délce při konstantní vlnové délce emitovaného záření.
Fluorescence se řídí několika pravidly
- Stokesův zákon – vlnová dálka fluorescenční emise při fotoluminiscenci je vždy větší nebo rovna vlnové délce excitačního záření (snížení energie emitovaného záření a tedy zvětšení jeho vlnové délky).
- Kashovo pravidlo – před emisí fluorescenčního kvanta dochází k relaxaci vibrační energie a vnitřní konverzi, takže nastává fluorescenční přechod z nejnižší vibrační hladiny prvního excitovaného stavu.
- Vavilův zákon – kvantový výtěžek a doba trvání excitovaného stavu složitých molekul v roztoku nezávisí na vlnové délce budícího záření.
Charakteristiky fluorescence[upravit | editovat zdroj]
Hlavními charakteristikami jsou:
- intenzita – počet fotonů procházejících v daném směru jednotkovou plochou za jednotku času
- spektrální složení – spektrální hustota fotonového toku na jednotkový interval vlnových délek nebo frekvencí
- polarizace – směr kmitání elektrického vektoru elektromagnetické vlny
- doba dohasínání – je dána vnitřní dobou života excitovaného stavu, z něhož dochází k emisi; úzce souvisí s pochody vedoucími k nezářivé deaktivaci tohoto stavu
- koherenční vlastnosti – vztahy mezi fázemi světelných vln
Fluofory[upravit | editovat zdroj]
Vlastní fluofory[upravit | editovat zdroj]
Vlastní (vnitřní) fluofory jsou chemické sloučeniny, jejichž přítomnost indikuje schopnost látky vyzařovat fluorescenční záření. Vnitřní fluorescence buněk bývá podmíněna přítomností některých proteinů, zejména takových, které ve svých molekulách obsahují aromatický cyklus. Tyto aminokyseliny (tryptofan, tyrosin a fenylalanin) vykazují fluorescenci v UV oblasti spektra. V UV oblasti dále vykazují fluorescenci mitochondrie a jadérka (na vlnových délkách 330–350 nm). K identifikaci vitaminu A ve tkáních se využívá jeho intenzivní fluorescenci ve 480 nm. Mezi fluofory vyzařující elektromagnetické vlnění v červené části spektra potom řadíme barviva jako hemoglobin či chlorofyl, dále cytochromy, myoglobin, peroxidázu a další. Vnitřní fluorescence proteinů lze využít při stanovování koncentrace látky, nicméně při využití vnějších fluoforů je stanovení citlivější, protože emise proteinů je závislá na poloze molekuly aminokyseliny obsahující aromatický cyklus. Velmi často také dochází ke vzájemnému zhášení fluorescence přenosem energie (viz dále)
Nevlastní fluofory[upravit | editovat zdroj]
Nevlastní neboli vnější fluofory patří mezi látky ve spektroskopii široce využívané. Podle typu vazby, kterou se poutají ke sledované látce rozeznáváme fluorescenční sondy a fluorescenční značky. Fluorescenční značky (fluoresceinizothiokyanát, tetrametylrhodaminizothiokyanát aj. jsou ke studované látce vázány kovalentní vazbou, flourescenční sondy jsou do struktury zkoumané látky zavzaty vazbou nekovalentní. Fluorescenční sondy po navázání mění často své fluorescenční vlastnosti, samy o sobě často vykazují velmi malé fluorescenční schopnosti. Při spektroskopickém stanovování látek s využitím sond obsahujících proteiny, je nutné vzít v potaz také vnitřní fluorescenci neznačených proteinů dané látky a zvolit značky či sondy vykazující vyšší excitační a emisní vlnovou délku. Fluorescenční sondy dělíme podle jejich převažujícího využití do několika skupin. Jsou to:
- Fluorescenční sondy pro nukleové kyseliny
- Membránové fluorescenční sondy
- Fluorescenční sondy pro membránový potenciál
- Fluorescenční sondy pro přenos energie
- Fluorescenční sondy pro polaritu prostředí
Dále rozlišujeme fluorescenční indikátory, které je pro jejich spektrální citlivost na určitou látku možné využít při stanovování látek.
Zhášení fluorescence a fotobleaching[upravit | editovat zdroj]
Zhášení fluorescence[upravit | editovat zdroj]
Existují bimolekulární procesy, které snižují kvantový výtěžek fluorescence, nicméně fluorescenční spektrum zůstává zachováno. Tyto děje jsou neopomenutelnou a ve většině případů nežádanou součástí spektroskopických technik využívajících jevu fluorescence. Jedná se o tzv. zhášení fluorescence. Rozlišujeme dynamické zhášení, zapříčiněné srážkou excitované molekuly s molekulou zhášedla. Dochází pak k nezářivému návratu do základního stavu. Dynamického zhášení se využívá například při stanovení změn koncentrace iontů Cl-. Při tomto typu zhášení však nedochází ke změně struktury molekuly, na rozdíl od tzv. statického zhášení, kdy se vytváří nefluorescenční komplex. Při vysoké hustotě značení či při vysoké koncentraci může docházet k tvorbě excitovaného dimeru – excimeru. Funkci zhášeče pak přebírá samotná molekula fluoreskující látky, tudíž se jedná o samozhášení.
Fotobleaching[upravit | editovat zdroj]
Vlastností intenzivního světla je rozklad fluoforů, což omezuje a v konečném důsledku také ruší jejich schopnost emitovat fluorescenční záření. Spektroskopy jsou proto konstruovány tak, aby k tomuto jevu, který odborně nazýváme fotobleaching (vybělování), nedocházelo.
Využití[upravit | editovat zdroj]
Spektroskopie umožňuje bezkontaktně a nedestruktivně získávat kvantitativní (podle podle intenzity záření spektrálních čar) i kvalitativní (podle vlnových délek charakteristických spektrálních čar) informace o dané látce. Fluorescenční spektrální analýza využívá toho, že každá látka emituje určité vlnové délky jinak. Přístroje pro měření fluorescence jsou čtverého typu.
- Spektrofluorimetry
- Fluorescenční mikroskopy
- Fluorescenční skenery
- Průtokové cytometry
Fluorescenční spektroskopie je pro svou citlivost velmi perspektivní postup využívaný v celé řadě oborů. Nachází uplatnění napříč od potravinářství, přes kriminalistiku, analytickou chemii, farmaceutický průmysl až po medicínu. Spektrofluorimetrická detekce je často využívaná v zapojení k průtokovému systému, například sekvenční injekční analýzy. Dochází zde k lepšímu promíchání roztoků, výsledkem je větší přesnost měření. Fluorescenční sondy, značky a indikátory nalézají v oblasti fluorescenční spektroskopie také velmi široké využití. Pr představu uvádím některé z nich.
Stanovení pH uvnitř buněk[upravit | editovat zdroj]
Fluorescenční signál indikátoru SNARF-F5 je velmi citlivý na pH, čímž je umožněno jejich využití při měření pH uvnitř buněk. Dále indikátor Fura-2 vykazuje spektrální posuv v přítomnosti Ca2+, je proto využíván při testování změn elektrického potenciálu. K těmto účelům se využívá také indikátor PBFI, jež je citlivý na draslík. Pro stanovování živých buněk je nutné brát v potaz průchodnost/neprůchodnost indikátoru buněčnou membránou
Zkoumání životnosti buněk[upravit | editovat zdroj]
Fluorescenční spektroskopii je možné využít při zkoumání životnosti buněk, kdy fluorogenní substráty esteráz pronikající do buňky, kde převádí buněčné esterázy na fluoreskující produkt. Na základě nitrobuněčné retence fluoreskujících produktů je také možné měřit membránovou integritu. Jako příklad těchto sond lze uvést karboxyeosin diacetát či fluorescein diacetát.
Pro detekci mrtvých buněk se používají barviva pro nukleové kyseliny. Využívá se zde nepropustnosti těchto barviv přes membrány živých buněk. Jedná se například o propidium-jodid či cyaninová barviva. Dále je možné využívat redoxního potenciálu živých buněk. Zavedené sondy (např. resazurin) jsou těmito buňkami oxidovány nebo redukovány, přičemž je zaznamenávána změna fluorescence Dále jsou využívány sondy citlivé na transmembránový potenciál.
Stanovení rychlosti proliferace buněk[upravit | editovat zdroj]
Fluorescenčním měřením změn v obsahu nukleových kyselin je možno měřit změny v obsahu DNA a odvodit tak rychlost proliferace buněk.
Testování apoptózy[upravit | editovat zdroj]
Sondy pro nukleové kyseliny jsou využívány dále k testování apoptózy. Často se v tomto případě využívá měření změn mitochondrií či peroxidace lipidů, jež jsou v případě programované buněčné smrti spolehlivými ukazateli.
Studium funkce iontových kanálů a neurotransmiterových přenašečů[upravit | editovat zdroj]
Fluorescenční značky a sondy (např. fluorescein, Texas Red, značené protilátky) se dále využívají ke studiu funkce iontových kanálů a neurotransmiterových přenašečů.
Sledování transdukce nervového signálu[upravit | editovat zdroj]
Fluorescenční značky a sondy se často využívají k pozorování změn koncentrace nitrobuněčného vápníku, lipidového mechanismu či aktivace a inhibice proteinkináz a fosfoproteifosfatáz, čímž je v důsledku umožněno sledovat transdukci nervového signálu.
Mimo medicínu lze spektrofotometrických metod využít například pro studium látek tvořících aerosol, pro měření velikosti a pohyblivosti nanočástic, kvantitativní a kvalitativní rozbor léků a mnoho dalších.
Zdroje[upravit | editovat zdroj]
Web[upravit | editovat zdroj]
- SÝKORA, Jan. Fluorescenční mikroskopie a fluorescenční korelační spektroskopie jako nástroje pro měření velikosti a pohyblivosti nanočástic [online]. [cit. 2013-27-11]. <http://www.jh-inst.cas.cz/3nastroje/data/dokument/soubor/Sbornik_Sykora_prednaska_LS2008.pdf>.
- FIŠAR, Zdeněk. Principy fluorescenční spektroskopie [online]. [cit. 2013-27-11]. <http://psych.lf1.cuni.cz/fluorescence/Default.htm>.
- LIPPAY, Josef. Využití fluorescenční spektroskopie ve studiu látek tvořících aerosol [online]. [cit. 2013-27-11]. <https://dspace.vutbr.cz/bitstream/handle/11012/16019/Bakal%C3%A1%C5%99sk%C3%A1_pr%C3%A1ce_Lippay.pdf?sequence=1>.
- REICHEL, Jaroslav. Bohrův model atomu [online]. [cit. 2013-27-11]. <http://fyzika.jreichl.com/main.article/view/753-bohruv-model-atomu>.
- VÁCHA, Martin. Spektroskopie jednotlivých molekul [online]. [cit. 2013-27-11]. <http://www.vesmir.cz/clanek/spektroskopie-jednotlivych-molekul>.
- NEZNÁMÝ,. IR a UV VIS spektroskopie [online]. [cit. 2013-27-11]. <http://physics.ujep.cz/~mkormund/P219/NanoMataChar-prednaska3.pdf>.
- BERKA, Karel. Chemické nástroje detektvivů [online]. [cit. 2013-30-11]. <http://ksicht.natur.cuni.cz/serialy/detektivni-chemie/2>.
- HOFR, Ctirad. Vlastní fluorescence proteinů [online]. [cit. 2013-30-11]. <https://is.muni.cz/el/1431/podzim2007/Bi7230/um/3973768/09_Protein.pdf>.
- HOFR, Ctirad. Nevlastní fluorescence [online]. [cit. 2013-30-11]. <https://is.muni.cz/el/1431/podzim2010/Bi7230/um/6053971/6056654/10_NevlastniF.pdf>.
Literatura[upravit | editovat zdroj]
- NAVRÁTIL, Leoš a Jozef ROSINA, et al. Medicínská biofyzika. 1. vydání. Praha : Grada, 2005. 524 s. ISBN 80-247-1152-4.