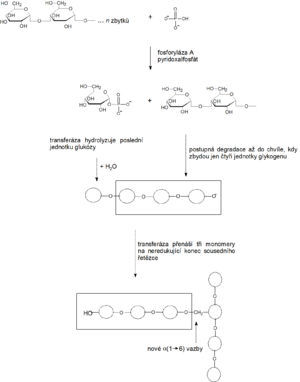Metabolismus glykogenu
Glykogen je rozvětvený homopolymer molekul glukózy. Většina glukózových zbytků je vázána pomocí α 1→4 vazeb. Každý dvanáctý glukózový zbytek je připojen k dalšímu zbytku pomocí α 1→6 vazby – vzniká místo rozvětvení molekuly glykogenu. Tyto větve jsou prodlouženy dalšími glukózovými zbytky spojenými α 1→4 vazbami. Vytvářejí se tak nerozpustné molekuly glykogenu připomínající svou strukturou větve stromu. Veškeré reakce při metabolismu glykogenu probíhají pouze na neredukujících koncích jeho molekuly – ty mohou být zkracovány či prodlužovány.
Funkce glykogenu[upravit | editovat zdroj]
Glykogen slouží u živočichů jako zásobárna sacharidů, ze které se mohou štěpením uvolňovat estery glukózy. Bohatě hydratovaná glykogenová granula se nacházejí v cytoplazmě všech buněk. Lidské tělo může skladovat přibližně 450 g glykogenu. Z tohoto množství se 80–100 g nalézá v játrech – tzv. jaterní glykogen, který se využívá pro udržování stálé hladiny glukózy v krvi (glykémie). Dalších 300 g je ve svalových buňkách – tzv. svalový glykogen. Ten slouží spíš jako interní svalová energetická zásoba při konání svalové práce. Svalové buňky neobsahují glukóza-6-fosfatázu, a proto svaly nemohou uvolňovat čistou glukózu do krevního oběhu. Zbytek (cca 50 g glykogenu) připadá na ostatní buňky lidského těla.
Glykogen jako zásobárna energie[upravit | editovat zdroj]
Jak již bylo uvedeno výše, glykogen není hlavní energetickou zásobou organismu (jaterní glykogen se vyčerpá během 12–24 hodin hladovění). Jde totiž o polární, bohatě hydratovanou molekulu a vázaná voda jen „zabírá místo” a nepřináší energetický zisk. Zásoba energie v tukové tkáni je mnohem úspornější – není totiž hydratovaná (TAG mají hydrofobní charakter) a současně jsou mastné kyseliny tvořeny redukovanějším uhlíkatým skeletem −CH2 – proti sacharidům −CH(OH)−. Jejich oxidací se uvolní větší množství energie. Glykogen nicméně představuje zásobárnu glukózy, což je důležité například pro buňky na glukóze závislé (např. mozek, erytrocyty).
Histochemický průkaz[upravit | editovat zdroj]
V histochemii se jeho přítomnost dokazuje tzv. PAS-reakcí (oxidace sousedních dvou hydroxylových skupin kyselinou jodistou a následná reakce takto vzniklých aldehydových skupin se Schiffovým činidlem).
Glykogeneze (syntéza glykogenu)[upravit | editovat zdroj]
Proces syntézy glykogenu probíhá v cytozolu. Intenzivní je hlavně v játrech a kosterní svalovině. Syntéza glykogenu vychází z molekul glukózy a vyžaduje navíc tzv. primer – tj. molekulu, která obsahuje řetězec několika glukóz spojených glykosidovými vazbami (nejčastěji jím je zbytek glykogenu přítomný v buňce, případně protein glykogenin).
Průběh[upravit | editovat zdroj]
- 1. Fosforylace glukózy na Glc-6-P
- v játrech katalyzuje tuto reakci glukokináza,
- ve svalech hexokináza.
- 2. Přeměna Glc-6-P na Glc-1-P
- pomocí fosfoglukomutasy
- 3. Glc-1-P reaguje s UTP
- za katalýzy UDP-glukózapyrofosforylázou,
- vzniká UDP-Glc, neboli aktivovaná forma glukózy (UDP se váže na C1).
- Tvorba glykosidových vazeb mezi molekulami glukózy je endergonický proces, a proto se vyžadují energeticky bohaté substráty. Přenos glukózových zbytků z UDP-Glc je přímý (ΔG < 0).
- 4. UDP-Glc se svým C1 připojuje na C4 neredukujícího konce glykogenu
- za katalýzy enzymem glykogensyntázou, a zároveň uvolní UDP.
- Vzniká tedy α 1→4 vazba O-glykosidová vazba.
- 5. Jakmile dosáhne rostoucí řetězec určité délky (> 11 glukózových zbytků), dojde k větvení molekuly.
- Z řetězce se pomocí tzv. větvícího enzymu (branching enzyme, amylo-(1,4-1,6)-transglykosyláza) odstraní oligosacharidový štěp složený ze 6–7 glukózových zbytků, který se následně připojí na −OH skupinu umístěnou na C6 molekuly glukózy lokalizované uvnitř řetězce glykogenu – vzniká α 1→6 vazba. Tyto větve mohou být nově prodlužovány pomocí akce glykogensyntázy (viz výše).
Regulace syntézy glykogenu[upravit | editovat zdroj]
Syntéza glykogenu probíhá v době, kdy má organismus dostatečný přísun energetických substrátů z potravy, tj. může tvořit energetické zásoby na horší časy. Hlavním regulačním enzymem je glykogensyntáza. Její aktivita se reguluje pomocí fosforylace – pokud je enzym fosforylován, inaktivuje se, defosforylace naopak vede k aktivaci enzymu. Fosforylaci ovlivňuje poměr inzulin / glukagon (např. skrze intracelulární koncentraci cAMP). Zvýšení poměru aktivuje syntézu glykogenu (inzulin je anabolický hormon). Snížení poměru či katecholaminy ji naopak inhibují.
Glykogenolýza (degradace glykogenu)[upravit | editovat zdroj]
Glykogen není nikdy úplně degradován, jeho degradace probíhá v cytosolu buněk. Děje se tak postupně formou tzv. fosforolytického štěpení (fosforolýza, navázání anorganického fosfátu), kdy se pomocí enzymu glykogenfosforylázy (zkráceně fosforyláza) z neredukujících konců uvolňují jednotlivé monomerní jednotky glukózy ve formě Glc-1-P – tzv. Coriho ester. Při štěpení molekuly glykogenu tedy rovnou vzniká fosforylovaná glukóza, a to bez spotřeby ATP:
- N zbytků glukózy + HPO42- → Glc-1-P + (N−1) zbytků glukózy
Bohatě rozvětvená molekula glykogenu má mnoho neredukujících konců, a proto se glykogen odbourává rychle. Na tomto místě je užitečné zmínit, že štěpení polysacharidů v trávicím traktu probíhá zcela odlišně. Polysacharidy jsou zde nejdříve štěpeny uvnitř svých řetězců za vzniku kratších poly- a oligosacharidů. Následně se uvolňuje volná (nikoli fosforylovaná) glukóza.
Průběh glykogenolýzy[upravit | editovat zdroj]
- 1. Glykogenfosforyláza dovede štěpit pouze α-1→4 glykosidové vazby.
- Začíná štěpit glykogen od neredukujícího konce a vznikají Glc-1-P.
- 2. Glc-1-P se přeměňuje na Glc-6-P
- činností fosfoglukomutázy.
- 3. Odbourávání glykogenu
- zastaví se u 4. glukózového zbytku před místem větvení, kde se vyskytuje α 1→6 vazba.
- 4. Tzv. odvětvovací enzym (glukanotransferáza, transglykosidáza)
- oddělí od postranního řetězce štěp tvořený třemi glukózovými zbytky a přenese jej na konec lineárního (hlavního) řetězce. Tam ho napojí pomocí α 1→4 vazby.
- 5. V místě původního větvení zbývá již jen jeden zbytek vázaný α 1→6 vazbou
- je odštěpen pomocí enzymu amylo-α1→6-glukosidázy.
- Výsledně se vytváří nerozvětvený řetězec s možností dalšího štěpení prostřednictvím glykogenfosforylázy.
- 6. Glc-6-P se přeměňuje na glukózu
- pomocí glukóza-6-fosfatázy (katalyzuje odštěpení fosfátu).
- Tento enzym se vyskytuje v jaterních a ledvinných buňkách a v enterocytech, kde se váže na membrány hladkého endoplazmatického retikula.
- 7. Glc-6-P
- je do ER transportována pomocí enzymu translokázy.
- Toto oddělení do ER slouží k tomu, aby vznikající glukóza nebyla ihned zpětně fosforylována na Glc-6-P.
- 8. Volná glukóza je následně vypuštěna do krve, kde může sloužit jako zdroj energie.
Regulace glykogenolýzy[upravit | editovat zdroj]
Klesne-li koncentrace glukózy v krvi, dochází ke snížení poměru inzulin/glukagon v plazmě. Jaterní glykogen je za těchto podmínek odbouráván. Sníží-li se při hladovění nebo za stresových podmínek organismu obsah glykogenu v játrech, je glukóza syntetizována de novo reakcemi glukoneogeneze z necukerných zdrojů. Hlavním regulačním enzymem glykogenolýzy je glykogenfosforyláza, patřící mezi ty enzymy, jejichž aktivitu reguluje kovalentní modifikace molekuly. Přitom platí, že fosforyláza je aktivní fosforylovaná.
- Aktivovaná fosforyláza se označuje jako fosforyláza a .
- Neaktivní fosforylázu (nemá navázanou fosfátovou skupinu) nazýváme fosforyláza b.
Fosforylaci glykogenfosforylázy katalyzuje enzym fosforylázakináza, defosforylaci oproti tomu katalyzují proteinfosfatázy. Glykogenolýzu aktivují kontraregulační hormony – glukagon, katecholaminy a glukokortikoidy (např. kortizol), inzulin ji oproti tomu inhibuje.
Ve svalových buňkách se regulace glykogenolýzy spojuje i se změnou koncentrace Ca2+ iontů. Zvýšení jejich intracelulární koncentrace vyústí v aktivaci fosforylázykinázy a glykogenfosforylázy – aktivace glykogenolýzy. Prostředníky jejich účinku jsou jednak vazebná bílkovina kalmodulin, jednak kalmodulin-dependentní proteinkinázy.
Klinická korelace[upravit | editovat zdroj]
Vrozené poruchy metabolismu glykogenu se nazývají glykogenózy. Dochází při nich ke hromadění glykogenu v buňkách (hlavně v jaterních a svalových), což může vyústit v pestré spektrum příznaků – např. zvětšení jater, hypoglykémie či zaostávání ve vývoji. Jejich incidence činí přibližně 1 : 10 000. Nejznámějším typem je typ I – tzv. von Gierkeho choroba, kdy je defektní glukóza-6-fosfatáza.
Shrnutí regulací metabolismu glykogenu[upravit | editovat zdroj]
Z výše uvedeného jasně vyplývá, že regulace obou procesů, syntézy i degradace glykogenu, je protichůdná. Jednotlivé efekty shrnuje následující tabulka:
| Regulační enzym | Aktivace | Inhibice |
|---|---|---|
| Glykogenfosforyláza (glykogenolýza) | Glukagon, adrenalin (fosforylace), snížení poměru ATP/AMP Ca2+ (ve svalu) | Zvýšení poměru ATP/AMP Inzulin |
| Glykogensyntáza (syntéza glykogenu) | Inzulin (indukce) | Glukagon, adrenalin (fosforylace) |