Metabolické kostní onemocnění z nezralosti
(přesměrováno z Osteopenie z nezralosti)
Metabolické kostní onemocnění z nezralosti (MBD) neboli osteopenie, osteomalacie či rachitida při nezralosti je porucha procesu kostní mineralizace, která postihuje rizikové předčasně narozené novorozence. Zahrnuje poruchu tvorby organické kostní matrix (neboli osteoidu) i poruchu vlastní mineralizace, tedy zabudování minerálů (vápníku, fosforu a dalších) do nově syntetizovaného osteoidu.
Největší část kostní mineralizace fetálního skeletu se odehrává ve třetím trimestru těhotenství s maximem krátce před vlastním porodem. MBD proto postihuje zejména novorozence narozené před 28. týdnem těhotenství a novorozence s dalšími rizikovými faktory (opakované infekce, závažná forma bronchopulmonální dysplazie, významná resekce střeva atd.). Na rozvoji metabolického kostního onemocnění z nezralosti se podílí ztráta fetální akrece vápníku a fosforu, časnější začátek přestavby kostí, nedostatečný přísun minerálů (osteomalacie/rachitida) a porucha formace kostní matrix (osteopenie). Vzhledem k absenci široce akceptovaných diagnostických kritérií je přesná incidence MBD diskutabilní. MBD provází hypofosfatémie (P < 1,8 mmol) a hyperfosfatázémie (ALP > 500 IU/l).[1] Klinické známky se začínají objevovat mezi 5. a 11. týdnem věku a zahrnují zvýšenou dechovou práci na podkladě nestability hrudníku způsobené změkčením (či frakturami) žeber, zvětšení lebečních švů, neobvyklá prominence čela ("frontal bossing"), fraktury a postnatální růstové selhání. Mezi krátkodobé důsledky MBD patří zlomeniny kostí (žeber, humeru či femuru) obvykle mezi 3. a 6. měsícem nekorigovaného věku. Mezi dlouhodobé následky MBD patří tendence k nižší tělesné výšce a snížení kostní denzity a může se jednat o rizikový faktor rozvoje časné osteoporózy. Důležitá je včasná identifikace rizikových novorozenců, důsledný monitoring laboratorních parametrů kostního metabolismu a adekvátní individualizovaná suplementace jednotlivých živin (mateřské mléko nepokrývá dostatečně nutriční potřeby předčasně narozených dětí).[2][3]
Osteomalacie je porucha fyziologického procesu mineralizace, tj. zabudování minerálů do nově vytvořeného osteoidu. Nemineralizovaný osteoid způsobuje „měknutí“ kosti, což se může u novorozence klinicky prezentovat jako dolichocefalické oploštění lebky. Pokud porucha mineralizace postihuje i růstové chrupavky, jedná se o rachitidu. Je pro ni typická neostrá/nepravidelná hranice mezi růstovou chrupavkou a metafýzou na RTG zápěstí. Na rozvoji osteomalacie/rachitidy podílí zejména nedostatečný přísun vápníku, fosforu a vitaminu D. Po dobu otevřených růstových chrupavek se oba stavy (osteomalacie a rachitida) vyskytují současně.
Osteopenie je snížené množství kostní tkáně, tedy snížená tloušťka kompaktní kosti a snížená tloušťka nebo počet trámců spongiózní kosti. Na rozdíl od osteomalacie je zbylý osteoid mineralizován normálně. U nezralých novorozenců je osteopenie způsobená nedostatečnou tvorbou nebo zvýšenou resorpcí osteoidu. Osteopenie vzniká v důsledku některých systémových onemocnění, podávání některých léků (kortikosteroidů, furosemidu) či v důsledku nedostatečné mechanické stimulace.[2]
Patofyziologie[upravit | editovat zdroj]
Tvorba kostí: chondrogenní - z chrupavek; desmogenní - z vaziva (lebka, maxilla, mandibula). Zahrnuje tvorbu organické kostní matrix (neboli osteoidu) a její mineralizaci, tedy zabudování minerálů (vápníku, fosforu a dalších).
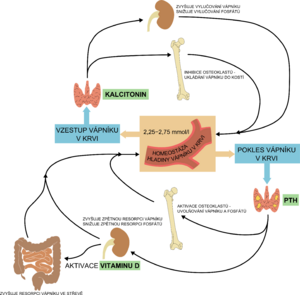
Při tvorbě kostí se uplatňují se vitaminy (A, C, D), cytokiny, minerály a hormony (tyroidální hormony, estrogen, kalcitonin, růstový hormon, parathormonu podobný peptid - PTHrP). Prenatálně dochází k aktivnímu transportu Ca, P a Mg placentou. Asi 99 % tělesného vápníku a 80 % fosforu je při narození v termínu porodu zabudováno v kostře, k tomuto transferu minerálů do kostry dochází mezi 25. týdnem těhotenství a termínem porodu. Postnatálně se tyto minerály vstřebávají pasivně a pak aktivně ze střeva.[1][4]
MBD: biochemické známky narušení metabolismu minerálů → snížená mineralizace → abnormální kostní remodelace a snížená lineární růstová rychlost → osteopenie (↓ matrix) a osteomalacie (↓ minerálů) → zlomeniny žeber a dlouhých kostí, kraniotabes a další.[5]
Biochemické změny při MBD:
- pokles sérové hladiny fosforu, hypofosfaturie a zvýšená tubulární reabsorpce fosforu;
- deficit fosforu → hyperkalcémie a hyperkalciurie; poměr kalcia : fosforu v moči (mmol/l) > 1.[5]
Rizikové faktory[upravit | editovat zdroj]
Etiologie metabolického kostního onemocnění u nezralých novorozenců je multifaktoriální, nejvýznamnějším faktorem je nedostatečná nutrice.
V posledním trimestru těhotenství dochází k ukládání vápníku a fosforu do kostí plodu, proto jsou MBD nejvíce ohrožené těžce nedonošené děti. Při tomto ukládání minerálů do skeletu má klíčovou roli placenta, proto při poruše její funkce dochází k riziku rozvoje MBD. Dalším rizikovým faktorem je potřeba dlouhodobé parenterální výživy, protože vápník a fosfor jsou v používaných roztocích špatně rozpustné, tudíž je nelze dodávat v dostatečném množství. Při mineralizaci kosti má hlavní roli fyzická aktivita, protože vývoj skeletu je určován funkčními požadavky.
Některé léky se při dlouhodobém podávání podílí na rozvoji MBD. Kortikosteroidy inhibují funkci osteoblastů, a také redukují střevní absorpci a tubulární reabsorpci kalcia (ta vede ke kalciurii se zvýšeným rizikem nefrokalcinózy). Furosemid a další kličková diuretika zvyšují renální ztráty Ca a tím vedou k jeho negativní bilanci (thiazidová diuretika mají opačný efekt). Aminophylliny (kofein, syntofylin) také vedou ke zvýšeným ztrátám Ca do moči, nicméně významnost je oproti steroidům a furosemidu podstatně nižší. Dlouhodobé podávání heparinu je také asociováno s poklesem kostní denzity. Heparin snižuje aktivitu osteoblastů, vede k abnormálnímu metabolismu vitaminu D a k sekundární hyperparathyreóze. Dlouhodobé užívání fenobarbitalu (a/nebo fenytoinu) urychluje degradaci vitaminu D, což může vést k nedostatečnému vstřebávání Ca.[2]
- Prenatální rizikové faktory
- Preeklampsie
- Chorioamniitida, placentární infekce
- Intrauterinní růstová restrikce[2]
- chronické podávání magnezia matce v těhotenství (může způsobit časnou osteopenii).[5]
- Postnatální rizikové faktory
- Nízké gestační stáří
- Velmi a extrémně nízká porodní hmotnost
- Poruchy výživy: opožděné dosažení plného enterálního příjmu, dlouhodobá parenterální výživa, deficience vitaminu D
- Hliníkem kontaminované roztoky parenterální výživy
- Léky (kortikosteroidy, furosemid, kofein, syntophyllin, heparin, fenobarbital)
- Neonatální morbidita: bronchopulmonální dysplazie, nekrotizující enterokolitida, vrozené vady střeva vedoucí k resekci/enterostomii, cholestáza, opakované infekce
- Nedostatek mechanické stimulace/imobilita: dlouhodobá potřeba sedace, relaxace, mozkové patologie.[2]
Klinický obraz[upravit | editovat zdroj]
MBD se manifestuje obvykle mezi 6. a 12. týdnem věku a je často asymptomatické. Těžké formy MBD se manifestují:
- neprospíváním a růstovým selháním,
- nálezy připomínajícími rachitidu (rickets-like) - růstová retardace, prominence čela ("frontal bossing"), kraniotabes (změknutí a ztenčení kostí lebky okcipitálně a/nebo parietálně), rachitický růženec (prominence kostochondrální junkce), rozšíření epifýz;
- zlomeninami,
- dechovými potížemi na podkladě zvýšené compliance hrudní stěny;
- myopií z nezralosti - důsledek změny tvaru lebky při osteopenii.[1]
Diagnostika[upravit | editovat zdroj]
Diagnostika je založená na identifikaci rizikových faktorů, klinickém stavu, dynamice biochemických markerů a zobrazovacích vyšetřeních.
Biochemické markery[upravit | editovat zdroj]
- neexistuje jediný spolehlivý parametr kostního metabolismu pro diagnostiku MBD, používá se proto kombinace více markerů:
Doporučení pro screening MBD u rizikových předčasně narozených dětí (všichni novorozenci s porodní hmotností < 1,5 kg a dále novorozenci s dalšími rizikovými faktory):
MBD: P < 1,8 mmol/l, ALP > 8,3 μkat/l (> 500 IU/l), TRP > 95 % (→ deficit fosforu); parathormon > 180 mg/dl.[1]
Pokles sérové hladiny fosforu pod 1,8 mmol/l, tj. pod hodnotu renálního prahu pro fosfor, je u nedonošených novorozenců možné považovat za známku fosfátového deficitu a rizikový faktor rozvoje MBD. Vyšetření má dobrou specificitu (95 %), ale velmi nízkou senzitivitu (50 %). Deficit fosforu může být nejčasnější známkou špatné mineralizace.
Hladina sérového kalcia je udržována stabilní i z cenu významné demineralizace kostí, proto ji nelze využít k diagnostice MBD.
Sérová hladina alkalické fosfatázy (ALP) je běžně užívaným parametrem kostního metabolismu, přestože je její přínos limitovaný. U novorozenců představuje kostní isoforma 90 % celkové ALP, zbytek představují isoformy jaterní a ledvinné. Vyšetřením bilirubinu a jaterních enzymů lze odlišit elevaci celkové (tkáňové nespecifické) ALP na podkladě elevace jaterní isoformy (tedy poškození hepatocytů). Elevace ALP provází normální růst kosti, hojení MBD i zvýšený obrat při neadekvátní mineralizaci (při nedostatku substrátu k tvorbě hydroxyapatitu) - tzn. zvýšenou aktivitu osteoblastů i osteoklastů. Při deficitu zinku či malnutrici (např. u novorozenců po resekci střeva vyžadujících dlouhodobou parenterální výživu) může být hladina ALP nepřiměřeně nízká. Nebyla prokázána souvislost mezi ALP a hladinou vitaminu D u novorozenců velmi nízké porodní hmotnosti. Nebyla prokázána souvislost mezi hladinou ALP a RTG známkami demineralizace kosti či kostní denzitou na denzitometrii. ALP tudíž nereflektuje minerální zásoby pacienta, nelze podle žádné její hodnoty řídit suplementaci Ca a P. Velmi vysoké hladiny ALP (> 20 μkat/l) jsou asociovány s malým vzrůstem v dětství.[2][1]
Kombinace hladiny ALP a P spojení ALP a P poskytuje 100% senzitivitu (ALP > 15 μkat/l a P < 1,5 mmol/l), ale pouze 70% specificitu pro sníženou kostní denzitu.[7]
Odpady kalcia a fosforu do moči
K posouzení adekvátního příjmu minerálů potřebných k tvorbě hydroxyapatitu lze využít stanovení prostých močových koncentrací Ca a P nebo jejich kreatininové indexy, které zohledňují zahuštění moči. Nevýhodou je absence jednoznačných referenčních mezí pro nezralé novorozence. U extrémně nezralých novorozenců bývá zvýšená exkrece fosforu do moči i při nízkých sérových hladinách fosforu.
Další možností je výpočet tubulární reabsorpce fosfátů (TRP) podle vzorce: 1- (U-P (mmol/l) x S-krea (mmol/l) / (U-krea (mmol/l) x S-P (mmol/l)) x 100. Tubulární reabsorpce nad 95 % je považována za známku nedostatku P v organismu. Jedná se o poměrně složitý výpočet s nutností znalosti sérové hodnoty kreatininu, neposkytuje žádnou informaci o stavu zásob kalcia a může být ovlivněn sekundární hyperparathyreózou při depleci Ca (TRP bude jistě pod 95 % při fosfaturii vyvolané parathormonem).
Nelze pochopit (syntaktická chyba): {\displaystyle TRP=(1-\frac{P[U] × kreatinin[S]}{P[S] × kreatinin[U]}\,)\,×100}
Renální nálož Ca vychází z rozdílu mezi střevní absorpcí a kostní retencí. Hlavními faktory ovlivňujícími odpady Ca do moči u nezralých novorozenců jsou nedostatek fosforu (není substrát pro tvorbu hydroxyapatitu → kalciurie), nedostatečný příjem/vstřebání vápníku a léky (furosemid, kortikosteroidy, kofein, aminophyllin → kalciurie i přes možný absolutní nedostatek). Absorpce fosfátů ve střevě je velmi efektivní a neregulovaná. Ledviny mají klíčovou úlohu v udržování sérové hladiny fosforu cestou jeho exkrece (regulováno pomocí parathormonu (PTH) a fibroblastového růstového faktoru 23 (FGF23). Tubulární reabsorpce je aktivní a saturabilní proces.
K fosfaturii dochází při překročení renálního prahu pro fosfor, tím by u VLBW novorozenců měla být sérová hladina P 1,8 mmol/l. Při poklesu pod tuto hodnotu v séru je všechen P z moči vstřebán. Maximální sérová hodnota P, nad kterou je 100% saturována reabsorpce, je 2,45 mmol/l (další zvýšení renální nálože zvyšuje pouze odpady do moči). U extrémně nezralých novorozenců (23.–25. gestační týden) je renální práh pro fosfor ještě snížen. I při fosfatémii kolem 1 mmol/l byla zjištěna pozitivní exkrece P v prvních 5 týdnech života, později renální práh stoupá k sérové hodnotě 1,8 mmol/l.[2]
Vitamin D
Prenatálně je pro normální vývoj a optimální mineralizaci fetálního skeletu nezbytná součinnost PTH a PTHrP (PTH related peptide), přítomnost vitaminu D (kalcidiolu, kalcitriolu) nezbytná není. Postnatální úlohou aktivovaného vitaminu D (kalcitriolu) je zajištění absorpce Ca (v menší míře i P) ze střeva.
Hypovitaminóza D patří u nedonošených dětí mezi rizikové faktory rozvoje metabolického kostního onemocnění při nezralosti (MBD), cestou sekundární hyperparathyreózy vede k resorpci Ca z kostí. Nejlepší marker k hodnocení stavu zásob vitaminu D je 25-hydroxyvitamin D (25-OHD, kalcidiol). Přestože vitamin D hraje významnou roli v kalcium-fosfátovém metabolismu, stanovování jeho sérové hladiny v rámci diagnostiky MBD není součástí základního panelu vyšetřování, protože prozatím neexistují žádná klinická data, která by to podporovala. Sérovou hladinu vitaminu D je vhodné hlídat u novorozenců s rizikem malabsorpce (cholestáza, resekce střeva).[2]
Hladina 25-OHD u novorozence koreluje s hladinou matky v těhotenství – u donošených novorozenců obvykle dosahuje hladina 25-OHD 70–100 % hladiny matky v těhotenství. V těhotenství má řada žen insuficienci až deficit vitaminu D (25-OHD < 50 resp. 25 nmol/L). Hypovitaminóza D u těhotné ženy a v pupečníkové krvi novorozence je asociována s rozvojem diabetu mellitu 1. typu v dětství, alergií, poruchami vývoje řeči a poruchou funkce imunitního systému novorozence (na úrovni střevní sliznice a sliznice dýchacích cest).[8][9][10][11][12][2]
Parathormon
Vzestup hladiny parathormonu (sekundární hyperparathyreóza) je citlivým ukazatelem deficitu vápníku a zřejmě by mohl být používán jako časný marker MBD po konfirmaci referenčních mezí pro nezralé novorozence. Parathormon stimuluje proliferaci a diferenciaci osteoklastů a tím vede k dalšímu vyplavování minerálů již z demineralizované kosti nezralých novorozenců.[2]
| Vitamin D | Parathormon | Kalcitonin | |
|---|---|---|---|
| ledviny | ↑ reabsorpci Ca2+ a fosfátů | ↑ resorpci Ca2+ a exkreci fosfátů, stimuluje produkci kalcitriolu |
↑ vylučování Ca2+, ↑ vylučování fosfátů |
| kost | mineralizace kostí; vysoké hladiny naopak odvápňují |
resorpce kostí (aktivace osteoklastů), kalcemie a fosfatemie stoupá |
inhibice osteoklastů, ukládání Ca2+ do kostí |
| střevo | stimuluje resorpci Ca2+ a fosfátů | stimuluje produkci kalcitriolu → stimuluje resorpci Ca2+ a fosfátů |
– |
Další metody[upravit | editovat zdroj]
RTG vyšetření se využívá k objektivizaci stavu skeletu v případě podezření na MBD. Není ale přínosné pro časnou diagnostiku MBD, navíc je zatíženo subjektivní chybou. Typické změny lze detekovat až při 20–40% snížení mineralizace kosti.
Kostní denzitometrie měří kostní denzitu (množství minerálů v kosti ve sledovaném úseku nebo objemu kosti). Dvoufotonová RTG absorpční fotometrie (DEXA), která je v současné době považována za zlatý standard pro vyšetření dospělých, se v neonatologii využívá pouze ke klinickému výzkumu.[2]
Kvantitativní ultrazvuková denzitometrie (QUS) - vyšetření obsahu kostních minerálů a organické matrix se v neonatologii využívá pouze ke klinickému výzkumu.[15]
Prevence a léčba[upravit | editovat zdroj]
U předčasně narozených dětí je důležité důsledně suplementovat vápník, fosfor, magnesium a vitamin D. Vhodné je časné zahájení enterální výživy, zkrácení délky parenterální výživy, fortifikace mateřského mléka (mateřské mléko obsahuje pouze asi 0,5 mmol fosforu/100 ml)[5] či podávání speciálních formulí pro předčasně narozené děti, adekvátní suplementace vitaminu D. Tabulka shrnuje doporučené denní dávky a cílové sérové hodnoty.
| Doporučený denní přísun u předčasně narozených novorozenců[16] | |||
|---|---|---|---|
| Parenterální výživa v prvních dnech života | Parenterální výživa po prvních dnech života | Enterální výživa | |
| Vápník (celkový) | 1,5 - 2 (min. 1) | 1,25 - 2 | 3 - 5,5 mmol/kg/den |
| Fosfor | 1 - 2 | 1,25 - 3 (obvykle max. 2 kvůli rozpustnosti) | 2,3 - 3,9 mmol/kg/den |
| Vápník : fosfor | 0,8-1 : 1 | 1,3-1,5 : 1 | 1,6-1,8 : 1 |
| Magnezium | 0,1 - 0,2 | 0,2 - 0,3 | 0,33 - 0,62 mmol/kg/den |
| Vitamin D | 400 | 400 | 400 - 1000 IU/den |
| Cílové sérové hladiny[16] | ||
|---|---|---|
| Normální hodnoty | Deficit | |
| Vápník (celkový) | 2,2 - 2,5 mmol/l | < 1,75 - 2,2 |
| Fosfor | 1,8 - 2,6 mmol/l | < 1,3 |
| Magnezium | 0,7 - 1,5 mmol/l | < 0,7 |
| Vitamin D | 30 - 80 mmol/l | < 20 |
Další důležité faktory:
- Fyzická aktivita či mechanická stimulace pasivním cvičením zlepšuje mineralizaci kostí.
- Minimalizovat užívání furosemidu a kortikosteroidů.
- Zvýšená pozornost u dětí s cholestázou a malabsorpcí (důsledná suplementace vitaminů rozpustných v tucích).[1]
Možnosti suplementace[upravit | editovat zdroj]
- Vitamin D - Vigantol;
- Ca a P - fortifikace mateřského mléka; kapsle s vápníkem; fosfátový roztok (Ca a P se podává odděleně kvůli riziku precipitace).
Odkazy
Související články[upravit | editovat zdroj]
Externí odkazy[upravit | editovat zdroj]
- Aplikace ke zhodnocení parametrů kostního metabolismu a doporučení terapie
- L. Petrů: Otrava fosfátovým sirupem
Reference[upravit | editovat zdroj]
- ↑ a b c d e f GOMELLA, Tricia, Fabien EYAL a Fayez BANY-MOHAMMED. Gomella's Neonatology, Eighth Edition. 8. vydání. McGraw-Hill Education, 2020. 1472 s. s. 1022-1026. ISBN 9781259644818.
- ↑ a b c d e f g h i j k MATĚJEK, T, et al. Metabolické kostní onemocnění při nezralosti. Čes-slov Pediat [online]. 2015, roč. 70, vol. 5, s. 303-312, dostupné také z <https://www.prolekare.cz/casopisy/cesko-slovenska-pediatrie/2015-5/metabolicke-kostni-onemocneni-pri-nezralosti-56516/download?hl=cs>.
- ↑ a b FAIENZA, Maria Felicia, Elena D'AMATO a Maria Pia NATALE. Metabolic Bone Disease of Prematurity: Diagnosis and Management. Frontiers in Pediatrics. 2019, roč. ?, vol. 7, s. ?, ISSN 2296-2360. DOI: 10.3389/fped.2019.00143.
- ↑ KOVACS, Christopher S.. Bone Development in the Fetus and Neonate: Role of the Calciotropic Hormones. Current Osteoporosis Reports. 2011, roč. 4, vol. 9, s. 274-283, ISSN 1544-1873. DOI: 10.1007/s11914-011-0073-0.
- ↑ a b c d RENNIE, JM, et al. Textbook of Neonatology. 5. vydání. Churchill Livingstone Elsevier, 2012. s. 920. ISBN 978-0-7020-3479-4.
- ↑ ABRAMS, Steven A., Jatinder J. S. BHATIA a Steven A. ABRAMS. Calcium and Vitamin D Requirements of Enterally Fed Preterm Infants. Pediatrics. 2013, roč. 5, vol. 131, s. e1676-e1683, ISSN 0031-4005. DOI: 10.1542/peds.2013-0420.
- ↑ Backström MC, Kouri T, Kuusela AL, et al. Bone isoenzyme of serum alkaline phosphatase and serum inorganic phosphate in metabolic bone disease of prematurity. Acta Paediatr 2000; 89 (7): 867–873
- ↑ Zipitis CS, Akobeng AK. Vitamin D supplementation in early childhood and risk of type 1 diabetes: a systematic review and meta-analysis. Arch Dis Child 2008; 93 (6): 512–517.
- ↑ Reinholz M, Ruzicka T, Schauber J. Vitamin D and its role in allergic disease. Clin Exp Allergy 2012; 42 (6): 817–826.
- ↑ Whitehouse AJ, Holt BJ, Serralha M, et al. Maternal serum vitamin D levels during pregnancy and offspring neurocognitive development. Pediatrics 2012; 129 (3): 485–493.
- ↑ Walker VP, Zhang X, Rastegar I, et al. Cord blood vitamin D status impacts innate immune responses. J Clin Endocrinol Metab 2011; 96 (6):1835–1843.
- ↑ Dinlen N, Zenciroglu A, Beken S, et al. Association of vitamin D deficiency with acute lower respiratory tract infections in newborns. J Matern Fetal Neonatal Med 2015; 19: 1–5.
- ↑ SILBERNAGL, Stefan a Agamemnon DESPOPOULOS. Atlas fyziologie člověka : 6. vydání, zcela přepracované a rozšířené. 3. vydání. Praha : Grada, 2004. s. 290-293. ISBN 80-247-0630-X.
- ↑ LEBL, J, J JANDA a P POHUNEK, et al. Klinická pediatrie. 1. vydání. Galén, 2012. 698 s. s. 189-196. ISBN 978-80-7262-772-1.
- ↑ KORČEKOVÁ, Zuzana, Peter KORČEK a Václav ČUNÁT. Tibial speed of sound changes in preterm infants during the first year of life. Bone. 2020, roč. ?, vol. 132, s. 115191, ISSN 8756-3282. DOI: 10.1016/j.bone.2019.115191.
- ↑ a b KOLETZKO, Berthold. Nutritional Care of Preterm Infants : Scientific Basis and Practical Guidelines. - vydání. Karger, 2021. 460 s. s. 138, 147. ISBN 9783318066463.