Reoxidační a reperfusní poškození tkáně
Poškození ischemické tkáně po obnovení průtoku krve. Bývá významné po krátké ischemii. Pokud je tkáň zcela poškozena, reoxygenace na ni nemá příliš velký vliv. Dochází však k vyplavení toxických látek (ROS, NO, eikosanoidy) z odumřelé tkáně do cirkulace.
Poškození tkáně toxiny vyvolávají MODS (multiple organ dysfunction syndrome) – syndrom multiorgánové dysfunkce a SIRS (systemic inflammatory response syndrome) – syndrom systémové zánětlivé odpovědi.
Ischemicko-reperfuzní poškození[upravit | editovat zdroj]
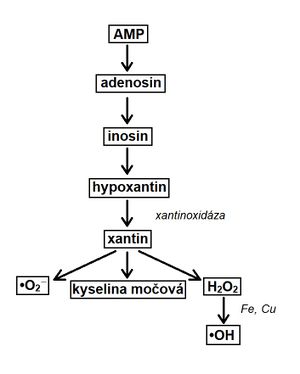
Nedostatek kyslíku způsobí přechod na anaerobní glykolýzu. Snížená produkce ATP podmíní vznik ATP ze dvou molekul ADP. Tím dochází ke vzniku ATP a AMP. Po reperfuzi je AMP z těla odstraňováno xantinoxidázovou cestou.
Pro přeměnu hypoxantinu je potřeba enzym xantinoxidáza. U člověka je přítomna pouze v játrech, střevě a laktující mléčné žláze. V srdci nelze hypoxantin odbourat (hromadí se). V průběhu přeměny dochází ke vzniku reaktivních forem, které mohou poškozovat organismus (pokud nejsou dostatečně rychle odbourány).
Přeměna AMP na kyselinu močovou viz schéma.
ROS po reperfuzi vznikají také v leukocytech (no-flow fenomén). Leukocyty vzájemně adherují a následně ucpávají kapiláry. Dále vznikají v mitochondriích, kde dochází k většímu úniku elektronů z komplexů v dýchacím řetězci a v důsledku MPT.
MPT (Mitochondrial permeability transition)[upravit | editovat zdroj]
Megakanál ve vnitřní mitochondriální membráně, který je propustný pro všechny molekuly menší než 1500 daltonů. Jeho otevření je podmíněno určitým množstvím vápníku v mitochondriální matrix. Dále ho mohou stimulovat oxidanty, depolarizace a anorganický fosfát. Inhibovat otevření MPT mohou protony, Mg2+, ATP, ADP a cyklosporin A.
Fyziologicky slouží MPT k výhodnému efluxu vápníku z mitochondrie (kalciová signalizace). Patologicky navozuje buněčnou smrt (apoptóza, nekróza), případně označuje staré mitochondrie pro autofagii. Otevřením MPT dojde ke kolapsu potenciálu vnitřní membrány a následnému vyrovnání protonového gradientu. Dojde k inhibici respirace. Následuje zbobtnání mitochondrií, uvolnění cytochromu c do cytosolu, což vede k apoptóze buňky.
Snížené pH při ischemii chrání před vznikem MPT.
Při reperfuzi v myokardu nastávají podmínky pro MPT souhrou následujících dějů:
- nadprodukce oxidantů;
- deplece adeninových nukleotidů;
- vysoká koncentrace Pi (z degradace ATP);
- vysoká koncentrace Ca2+;
- normalizace pH.
Při ojedinělém MPT se může stát, že H+ jdou ven, za štěpení ATP. Tím dojde ke snížení pH, což inhibuje vznik MPT. Při reperfuzi dochází k dalším ztrátám ATP, což zhoršuje stav buňky.
Poly(ADP-riboza)-polymeráza (PARP-1)[upravit | editovat zdroj]
Enzym vázaný na chromatin, který se aktivuje oxidačním poškozením DNA. Jeho funkcí je štěpení NAD+ a přenos poly(ADP-ribózy) na jaderné proteiny. Fyziologicky pomáhá při opravách DNA a podporuje přežití buňky. Nadměrné poškození DNA způsobí depleci NAD+, která urychlí buněčnou smrt. Depleci NAD+ způsobují do jisté míry i MPT.
Prevence[upravit | editovat zdroj]
Stále není jednoznačné. Teoreticky lze říci, že prevencí by měla být řízená hypotermie, MPT inhibitory (např. Cyklosporin A), antioxidanty a PARP-1 inhibitory.