Obrovskobuněčná arteriitis
(přesměrováno z Giant cell arteritis)
Úvod[upravit | editovat zdroj]
Obrovskobuněčná arteritida (Giant cell arteritis, GCA) je chronická systémová vaskulitida středních a velkých cév obsahujících lamina elastica interna. Klinický popis choroby poprvé prezentoval Dr. Hutchinson v roce 1890. Ale až v roce 1930 Dr. Horton popsal její histopatologický obraz (po něm je též nazvána jako Hortonova choroba). Dalším možným názvem je Temporální arteritida (často postihuje a. temporalis spf., a. ophtalmica, a. ciliaris post., aa. vertebrales). Vyskytuje se zejména u pacientů nad 50 let, u mladších pacientů jen extrémně vzácně, často společně s Polymyalgia rheumatica (PMR – ranní ztuhlost krku, bolesti svalů ramene a pánve, zvýšené hodnoty reaktantů akutní fáze), zhruba 30–50 % má symptomy PMR před, zároveň nebo po diagnostice GCA. Přesný vztah mezi těmito dvěma chorobami není známý.
GCA se většinou rozvíjí pomalu, pro začátek jsou typické celkové příznaky (zvýšená teplota, únavnost, nechutenství, bolesti hlavy, ztráty hmotnosti), později příznaky podle postižené cévy: palpační bolestivost v oblasti a. temporalis, klaudikace žvýkacích svalů, diplopie, úplná ztráta zraku, syndrom aortálního oblouku s ischemií HK, dále Raynaudův fenomén a gangréna prstů. Etiologie je multifaktoriální (polygenní dědičnost, vliv prostředí). V patogenezi hrají hlavní úlohu makrofágy, dendritické buňky a Th lymfocyty. Biopsie a. temporalis a následná histologická verifikace je brána jako standard v diagnostice. Terapeutickým postupem je aplikace kortikoidů (40–60 mg/denně).
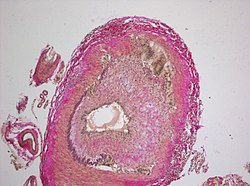
Histopatologický obraz[upravit | editovat zdroj]
Zánětlivý infiltrát ve všech vrstvách cévy s makrofágy a obrovskými mnohojadernými buňkami (i když v 30–50 % mohou chybět)[1] , které se formují v granulomy na hranici tunica media a tunica intima. V případě, že nejsou přítomny mnohojaderné buňky, sestává infiltrát hlavně z lymfocytů a malého množství neutrofilů a eozinofilů. Dále pozorujeme fragmentaci lamina elastica interna a zničení hladkých svalových buněk – jsou postupně nahrazeny fibrózou t. media. Typickým znakem je hyperplázie intimy – vede k okluzi cévy (a následné ischémii).
Patogeneze[upravit | editovat zdroj]
Hlavní úlohu v patogenezi GCA sehrávají:
- buňky: CD4+ T lymfocyty (hlavně Th1 a Th17), dendritické buňky, makrofágy a obrovské mnohojaderné buňky,
- enzymy a růstové faktory: metaloproteinázy, PDGF, VEGF, IFN–γ, IL-6, TNF-α a jiné.
Spouštěcí faktory nejsou známy, i když byly popsány případy vyššího výskytu GCA u pacientů po prodělané respirační infekci (M. pneumoniae, Ch. pneumoniae), případně po infekci parvovirem B19. Každopádně na začátku imunitní odpovědi stojí pravdepodobně zatím neznámý/é antigen/y v t. adventitia. Ten/ty rozeznávají T lymfocyty (které se do t. adventitia dostanou cestou vasa vasorum), podstupují klonální expanzi a začínají produkovat IFN–γ. Aktivované T lymfocyty exprimují na povrchu MHC II a CD25R – receptor pro IL-2, jsou nezbytné pro formaci granulomů, ačkoliv ty se formují především na hranici t. media a t. intima. Zatím není přesně objasněn mechanismus (ani cesta), kterým je tento proces umožněn. V prezentaci antigenu sehrávají hlavní úlohu dendritické buňky. Ty se za fyziologického stavu nacházejí v tunica adventitia a v případě, že se střetnou s antigenem (toll-like receptor (TLR) 4 a TLR 5), dochází k jejich aktivaci. Ta je na ligandu závislá – tj. různé typy bakteriálních antigenů vedou v konečném důsledku k rozdílnému charakteru zánětu.[2]
IFN–γ vede k aktivaci a migraci makrofágů (ty jsou považované za hlavní efektorové buňky GCA), které se spojují a vytvářejí obrovské mnohojaderné buňky. V různých částech cévy se makrofágy chovají rozdílně:
- v adventicii produkují IL-1 a IL-6, TNF-α a TGF-β, IL-32;
- v t. intima a t. media syntetizují (na základě IL-1β a TNF-α) metaloproteinázy (MMP-2, MMP-9) a oxid dusnatý (resp. reaktivní formy dusíku). Taktéž exprimují VEGF, PDGF (A a B), jeho exprese koreluje s mírou hyperplázie t. intima.
Úloha metaloproteináz spočívá v oxidaci makromolekul (lipidy, DNA) a v proteolytické aktivitě, jsou hlavní příčinou degradace lamina elastica interna. Kromě toho „natravují“ membrány buněk a uvolněné proteolytické enzymy dále degradují extracelulární matrix (ECM). Reaktivní formy dusíku mají za následek apoptózu hladkých svalových buněk t. media. VEGF se podílí na procesu angiogeneze, což dále narušuje strukturu stěny cévy a umožňuje dalším lymfocytům, aby se podílely na procesu destrukce. IL-6, kromě pro-zánětlivého působení, stimuluje in vitro angiogenezi a předpokládá se podobné působení i in vivo u GCA (existuje totiž doklad o úspěšné léčbě GCA protilátkou proti IL-6 receptorům).[3]
Po degradaci lamina elastica interna migrují myofibroblasty směrem k t. intima, usadí se v subendotelové vrstvě, kde začnou proliferovat a syntetizovat komponenty ECM. Kromě toho mnohojaderné buňky produkují PDGF, který působí jako stimul intimální proliferace. Dohromady tak oba typy buněk způsobí nekontrolovatelnou hyperplázii intimy, která může vést k zúžení lumen (od toho se odvíjí některé vážné symptomy: slepota, mrtvice). V posledních letech se zkoumá úloha Th17 lymfocytů v patogenezi GCA. Jejich aktivace je spojována s produkty makrofágů (IL-6, IL-1β). Tyto buňky produkují IL-17, který má svoje receptory na fibrobalstech, endotelu a hladkých svalových buňkách t. media. Předpokládá se silná potenciace zánětu právě díky účinkům IL-17.[4]
Diagnostika[upravit | editovat zdroj]
Fyzikální nález je nejasný, svědčí o stavu probíhajícího zánětu, pacient většinou udává nespecifické příznaky (viz kazuistika). Důležité jsou některé patologicky změněné laboratorní nálezy:
- sedimentace erytrocytů alespoň 50 mm/h (i když 20 % pacientů může mít sedimentaci ve fyziologickém rozmezí);
- výrazně zvýšené CRP, je dobré též stanovit hladinu IL-6;
- trombocytóza;
- mohou se vyskytnout abnormální hodnoty jaterních testů.
Při podezření na extrakraniální GCA je indikovaná arteriografie, CT, MRI angiografie. Typickým nálezem na angiografii je bilatelární stenóza poškozené tepny a ztluštění stěny v důsledku zánětu. CT je důležité hlavně při podezření na aneurysma, resp. disekci aorty (které se mohou vyvinout jako následek oslabené cévní stěny). Kromě toho se v posledních letech do diagnostiky dostává metoda 15 FDG PET (postižená céva vychytává značenou glukózu) a též barevná Dopplerova ultrasonografie tepny (charakteristický příznak je tzv. „halo sign“).
![]() Napříč všem moderním možnostem zůstává biopsie a. temporalis s následnou histologickou verifikací hlavním diagnostickým prostředkem. Optimální je provést biopsii co nejdříve, a to bitemporálně.
Napříč všem moderním možnostem zůstává biopsie a. temporalis s následnou histologickou verifikací hlavním diagnostickým prostředkem. Optimální je provést biopsii co nejdříve, a to bitemporálně.
Hlavní aspekty terapie[upravit | editovat zdroj]
Glukokortikoidy jsou lékem volby u každé GCA. Doporučuje se 40 – 60 mg prednisonu denně, při přítomnosti viditelných příznaků až 100 mg denně. Pacienta sledujeme a pokud klesne sedimentace a CRP z původních hodnot na polovinu, je možné pomalu snižovat dávky. Léčba je většinou nutná minimálně 2 roky.
Závěr[upravit | editovat zdroj]
Obrovskobuněčná arteritida je vaskulitida velkých tepen, postihuje zejména starší pacienty a nejčastěji postihuje tepny hlavy. Způsobuje okluzi lumen s ischémií tkání. Onemocnění většinou začíná pomalu s celkovými příznaky, s progresí choroby se mohou objevovat příznaky charakteristické pro postiženou oblast. V patogenezi sehrávají hlavní úlohu Th lymfocyty a jejich produkty IFN-γ a IL-17, dále dendritické buňky a makrofágy, jejichž produkty postupně destruují stěnu cévy. Při podezření na GCA je nutné provést biopsii a. temporalis. V terapii volíme vysoké dávky kortikosteroidů, prognóza je po této léčbě velmi dobrá.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
- Kazuistika k tomuto článku
- Obrovskobuněčná arteriitida (stručně)
- Glukokortikoidy
- Hlavní histokompatibilitní komplex
Reference[upravit | editovat zdroj]
- ↑ SALVARANI, Carlo, Fabrizio CANTINI a Luigi BOIARDI, et al. Polymyalgia rheumatica and giant-cell arteritis. N Engl J Med [online]. 2002, vol. 347, no. 4, s. 261 - 271, ISSN 0028-4793 (print), 1533-4406.
- ↑ DENG, Jiusheng, Wei MA-KRUPA a Andrew T GEWIRTZ, et al. Toll-like receptors 4 and 5 induce distinct types of vasculitis. Circ Res [online]. 2009, vol. 104, no. 4, s. 488-95, dostupné také z <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2731717/?tool=pubmed>. ISSN 0009-7330 (print), 1524-4571.
- ↑ SCIASCIA, Savino, Daniela ROSSI a Dario ROCCATELLO. Interleukin 6 blockade as steroid-sparing treatment for 2 patients with giant cell arteritis. J Rheumatol [online]. 2011, vol. 38, no. 9, s. 2080-1, dostupné také z <https://www.ncbi.nlm.nih.gov/pubmed/21885526>. ISSN 0315-162X.
- ↑ DENG, Jiusheng, Brian R YOUNGE a Richard A OLSHEN, et al. Th17 and Th1 T-cell responses in giant cell arteritis. Circulation [online]. 2010, vol. 121, no. 7, s. 906-15, dostupné také z <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2837465/?tool=pubmed>. ISSN 0009-7322 (print), 1524-4539.
Použitá literatura[upravit | editovat zdroj]
- ČEŠKA, Richard, et al. Interna. 1. vydání. Praha : Triton, 2010. 855 s. s. 611 - 613. ISBN 978-80-7387-423-0.
- HOŘEJŠÍ, Václav a Jiřina BARTŮŇKOVÁ, et al. Základy imunologie. 4. vydání. Praha : Triton, 2009. s. 102 - 108. ISBN 978-80-7387-280-9.
- BORCHERS, Andrea T a M Eric GERSHWIN. Giant cell arteritis: a review of classification, pathophysiology, geoepidemiology and treatment. Autoimmun Rev [online]. 2012, vol. 11, no. 6-7, s. A544-54, dostupné také z <https://www.ncbi.nlm.nih.gov/pubmed/22285588>. ISSN 1568-9972 (print), 1873-0183.
- WEYAND, Cornelia M a Jörg J GORONZY. Pathogenic mechanisms in giant cell arteritis. Cleve Clin J Med [online]. 2002, vol. 69 Suppl 2, s. SII28-32, dostupné také z <https://www.ncbi.nlm.nih.gov/pubmed/12086261>. ISSN 0891-1150.