Gibbsova energie (FBLT)
Rozdíl chemických potenciálů produktů a reaktantů souvisí s termodynamickou funkcí nazývanou změna Gibbsovy energie (ΔG). Z mnoha možných definic Gibbsovy energie jsou pro biochemii důležité dvě:
- Změna Gibbsovy energie je rovna maximálnímu množství (neobjemové) práce, kterou může systém vykonat;
- Změna Gibbsovy energie je mírou vychýlení se od rovnovážného stavu.
První definice nám říká, že ΔG můžeme použít k předpovědi, zda k reakci dojde a jestli ji lze využít jako zdroj energie pro jiné procesy (svalová kontrakce, přesun iontů přes membránu).
Druhá definice vyjadřuje dva fakty:
a) v rovnovážném stavu se ΔG rovná nule;
b) změna koncentrací látek v systému, který není v rovnováze, změní (zvýší nebo sníží) ΔG.
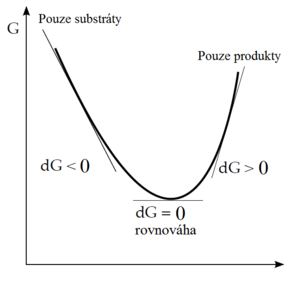
Smysl změny Gibbsovy energie se dá ilustrovat i následujícím zobrazením:
Pokud reakce začne jen se směsí reaktantů, bude probíhat směrem k produktům tak dlouho, dokud bude ΔG negativní. Nabude-li chemický potenciál produktů stejné hodnoty jako u reaktantů, systém dosáhl stavu nejnižší energie a reakce se zastaví. Reakční směs je nyní v rovnováze. Nedá se předpokládat, že by reakce pokračovala dál, protože ΔG je v další části křivky pozitivní.
Platí tedy:
ΔG < 0 – reakce probíhá spontánně; ΔG = 0 – rovnovážný stav; ΔG > 0 – reakce spontánně neprobíhá.
Změnu Gibbsovy energie můžeme také definovat prostřednictvím termodynamických veličin jako entalpie (H) a entropie (S):
| (5) |
- ΔG = ΔH – T · ΔS
Změna entalpie je energie uvolněná nebo spotřebovaná během reakce (negativní hodnota znamená uvolnění energie a naopak).
Entropie se často považuje za míru neuspořádanosti systému. Podle druhého zákona termodynamiky neuspořádanost (a tedy i entropie) všech uzavřených systémů narůstá.
Z rovnice (5) vyplývá, že chemická reakce může být poháněna (tzn. dosáhnout negativní ΔG) buď vhodnou (tedy negativní) změnou entalpie, nebo dostatečným nárůstem entropie, či oběma současně.
Z tabulkových hodnot ΔG0 nebo ΔG0′ můžeme vypočítat ΔG pro jakoukoliv reakci pomocí rovnice:
| (6) |
V rovnovážném stavu je ΔG rovné nule a výraz je roven rovnovážné konstantě Keq.
Rovnice (6) tedy v rovnovážném stavu nabývá podoby:
| (7) |
- ΔG = −R · T · ln Keq
Prostřednictvím této rovnice pak můžeme vypočítat rovnovážnou konstantu z ΔG či naopak.
Snadná dostupnost hodnot ΔG0 může vést k uspěchaným závěrům o nemožnosti průběhu reakce při nalezení pozitivních hodnot ΔG0 v tabulkách. Tomu je ale třeba se vyhnout.
Ukažme si to na následujícím příkladu: Metabolická dráha glykolýzy obsahuje krok, ve kterém dochází k přeměně glukóza-6-fosfátu na izomer, fruktóza-6-fosfát. ΔG0‘ této reakce činí +1,7 kJ/mol. Znamená to tedy, že naše buňky prováděním této reakce každou sekundu našeho života porušují zákony termodynamiky?
Je důležité mít na paměti rozdíl mezi ΔG a ΔG0 a ΔG0‘. Jen samotné ΔG nám může prozradit něco o termodynamickém profilu konkrétní reakce. Hodnoty ΔG0 a ΔG0‘ platí jen při zachování standardních podmínek, které ale jsou v přírodě velmi zřídka (jestli vůbec) přítomny. Abychom mohli posoudit pravděpodobnost, že k reakci dojde, musíme znát skutečné koncentrace všech látek, jež se jí účastní.
V našem případě enzymů dochází jejich činností k neustálému odstraňování fruktóza-6-fosfátu, a tak se jeho koncentrace udržuje nízká. Celkové ΔG izomerizace Glc-6-P na Fru-6-P je díky tomu za podmínek, které jsou v buňce, záporné (−2,5 kJ/mol). Vidíme tedy, že mohou probíhat i některé energeticky relativně nepříznivé reakce, jsou-li sdruženy s reakcemi energeticky příznivými (v tomto případě těmi, které odčerpávají produkty nebo dodávají reaktanty).
Pokud reakce přeměny A → B dosahuje rovnovážného stavu s nízkou koncentrací látky B, můžeme ji sdružit s reakcí přeměny B → C, která naopak dosahuje rovnovážného stavu pouze při nízkých koncentracích reaktantu B. Druhá reakce potom efektivně odstraňuje látku B tvořenou první reakcí a brání jí tak v dosažení rovnovážného stavu.
V našem příkladu glykolýzy enzym fosfofruktokináza velmi efektivně fosforyluje Fru-6-P na fruktózu-1,6-bisfosfát, čímž zamezuje hromadění Fru-6-P, který by předchozí reakci brzdil.

![{\displaystyle \Delta G=\Delta G^{0}+R\cdot T\cdot ln{\frac {[C]^{c}\cdot [D]^{d}}{[A]^{a}\cdot [B]^{b}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bcd22dcc82d9e6d9762126f24414f6b0c16f0d1a)
![{\displaystyle {\frac {[C]^{c}\cdot [D]^{d}}{[A]^{a}\cdot [B]^{b}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7111a4fb16c8e7a84736b85eaad4f6f73a1ddfd5)