Základy organické chemie (1.LF VL)
Alkoholy a fenoly
Alkoholy patří mezi nearomatické hydroxyderiváty uhlovodíků, zatímco fenoly obsahují hydroxylovou funkční skupinu vázanou přímo na benzenový kruh. Podle polohy –OH skupiny v alifatickém řetězci rozeznáváme alkoholy primární, sekundární a terciární.
Alkoholy
- Primární alkoholy

- -OH skupina je vázána na primární uhlík (tj. uhlík spojený s pouze jednou alkylovou skupinou).
- Sekundární alkoholy

- -OH skupina je vázána na sekundární uhlík (tj. uhlík spojený se dvěma alkylovými skupinami).
- Terciární alkoholy

- -OH skupina je vázána na terciární uhlík (tj. uhlík spojený se třemi alkylovými skupinami).
Příklady fenolů
Pro tyto látky je typická řada reakcí. Pro účely praktických cvičení se zaměříme pouze na oxidační reakce alkoholů a azokopulační reakce fenolů.
Oxidace alkoholů
- Primární alkoholy se vhodnými oxidačními činidly oxidují na aldehydy a dále na karboxylové kyseliny
- sekundární na ketony
- terciární se bez porušení uhlíkatého skeletu neoxidují
Z fenolů se oxidují pouze sloučeniny se dvěma -OH skupinami v o- a p- poloze za vzniku chinonů.
Vhodným oxidačním činidlem je například chromsírová směs, tj. oranžově zbarvený dichroman (tedy sloučenina Cr6+) s kyselinou sírovou, který se reakcí s primárním nebo sekundárním alkoholem redukuje na zelený síran chromitý (Cr3+).
Příkladem může být oxidace metanolu na formaldehyd:
- 3 CH3OH + K2Cr2O7 + 4 H2SO4 → 3 HCOH + Cr2(SO4)3 + K2SO4 + 7 H2O
Pokud chceme rozlišit primární a sekundární alkoholy, využijeme odlišných vlastností jejich oxidačních produktů, tedy aldehydů a ketonů. Aldehydy redukují Tollensovo, Fehlingovo nebo Benedictovo činidlo (viz níže). Nicméně nejcitlivější reakcí, která nevyžaduje produkci velkého množství aldehydu, a je tudíž pro stanovení vzniklého aldehydu vhodná, je reakce s Schiffovým činidlem.
Schiffovo činidlo je vodný roztok fialovočerveného barviva fuchsinu, ke kterému se přidává hydrogensiřičitan nebo siřičitan. Hydrogensiřičitan se aduje na centrální uhlíkový atom, tím je narušena chinoidní struktura podmiňující zbarvení. Vzniká bezbarvý roztok kyseliny fuchsinsiřičité. Po přidání i malého množství aldehydu se z vazby na fuchsin uvolní kyselina siřičitá, která se naváže na aldehydovou skupinu pevnější vazbou. V molekule fuchsinu dojde k obnovení chinoidní struktury a roztok se zbarví opět fialovočerveně.
Reakce se provádí v aparatuře znázorněné na obrázku. Opatrně se zahřívá směs alkoholu a kyseliny chromsírové. Vznikající aldehyd / keton se zavádí do zkumavky se Schiffovým činidlem, které v přítomnosti aldehydu zfialoví.
Reakce s Schiffovým činidlem se hojně využívá i v histologii při tzv. PAS reakci (Periodic Acid – Schiff) na průkaz glykogenu a dalších polysacharidů ve tkáních. Principem je oxidace sacharidů kyselinou jodistou (angl. periodic acid) na aldehydy, které poté reagují s Schiffovým činidlem za vzniku fialovo-červeného zbarvení.
Oxidace alkoholů v těle
Etanol je součástí řady alkoholických nápojů, léčiv, a rovněž se v malé míře spontánně produkuje v zažívacím traktu. V těle je metabolizován převážně játry, malé množství nezmetabolizovaného alkoholu se vylučuje plícemi, ledvinami a kůží. Hlavním systémem jaterního metabolismu etanolu je oxidace v cytoplasmě hepatocytů. V prvním kroku se etanol oxiduje na acetaldehyd enzymem alkoholdehydrogenázou (ADH, EC 1.1.1.1). Aktivita tohoto enzymu je dána geneticky a může vysvětlovat různou individuální vnímavost k alkoholu. Acetaldehyd je konvertován aldehyddehydrogenázami (ALDH, např. EC 1.2.1.3) na konečný acetát, který je dále metabolizován na acetyl-CoA.
Na rozdíl od etanolu, metanol je pro lidský organismus vysoce toxický i v malých dávkách. Po pozření 10 ml může dojít k nevratnému poškození optického nervu a oslepnutí, dávka kolem 30 ml je smrtelná. Příčinou vysoké toxicity methanolu je jeho oxidace využívající stejné enzymatické systémy jako etanol. ADH přemění metanol na toxický formaldehyd a z něj vznikne působením ALDH kyselina mravenčí, způsobující hypoxii na buněčné úrovni a metabolickou acidózu. Antidotem při otravě metanolem je etanol, kompetitivní inhibitor ADH, který zabrání vytvoření toxických metabolitů a umožní vyloučení metanolu ledvinami.
Azokopulační reakce fenolů
Arendiazoniové soli vznikají reakcí aromatických aminů s dusitanem sodným.
Skupina N+≡N je pak základem pro vznik dusíkového můstku, který spojí v kyselém prostředí arendiazoniovou sůl s fenolickou sloučeninou. Výsledkem je vznik barevné azosloučeniny, tedy látky s benzenovými jádry spojenými právě N=N můstkem.
Nejjednodušší azokopulační reakcí je vznik azobarviva reakcí arendiazoniové soli s fenolem. Vzniká žluté barvivo, označované jako anilinová žluť nebo sudanová žluť R.
Azosloučeniny se vyznačují různě bohatým π elektronovým systémem vazeb. Pokud skrz tento systém proniká bílé světlo, některé vlnové délky jsou elektronovým systémem absorbovány a výsledná barva je vlastně tvořena neabsorbovanými vlnovými délkami. Vznikají tak celé škály barevných sloučenin, které se dají využít v analytice při spektrofotometrických stanoveních v biochemii (žlučová barviva) nebo v průmyslu při výrobě barviv (diazobarviva).
Dalším příkladem azokopulační reakce je vznik oranžového azobraviva azokopulační reakcí s α-naftolem.
I relativně malá změna ve struktuře azobarviva může mít za následek odlišnou absorpci vlnových délek příslušnou látkou a tím i její barvu, kterou vnímáme. Toho se využívá např. při určování pH. Například metyloranž existuje ve dvou formách v závislosti na pH:
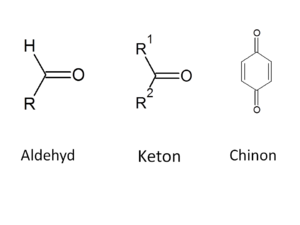
Karbonylové sloučeniny
Karbonylové sloučeniny ve své molekule obsahují C=O skupinu – tu nazýváme karbonylovou neboli oxoskupinou. Mezi karbonylové sloučeniny řadíme aldehydy, ketony a chinony (posledním se v tomto textu věnovat nebudeme). V případě ketonů jsou na oxoskupinu vázány dva uhlíkaté zbytky, zatímco aldehydy mají jednu valenci obsazenou vodíkem a druhou uhlíkatým zbytkem (v případě nejjednoduššího aldehydu, formaldehydu, jsou obě valence obsazeny vodíkem).
Vodík v aldehydové skupině je ochotným akceptorem elektronů – aldehydová skupina tak vykazuje redukční vlastnosti (sama se při redukci substrátu oxiduje na karboxylovou skupinu). Oproti tomu ketony redukční vlastnosti nemají a k jejich oxidaci dochází až za použití silných oxidačních činidel (přitom dochází ke štěpení uhlíkatého řetězce). Vzhledem k přítomnosti dvojné vazby nás nepřekvapí, že karbonylové sloučeniny mohou být substrátem redukčních reakcí – redukují se přitom na alkoholy.
Průkaz aldehydů
Velmi citlivou metodou průkazu aldehydové skupiny je reakce se Schiffovým činidlem.
Další skupina činidel prokazuje redukční vlastnosti aldehydů. Hlavní složkou bývá kovový kation, který se reakcí s aldehydem redukuje a přitom mění barvu. Někdy dochází k redukci až na elementární kov, který je pozorovatelný jakožto „kovové zrcátko“. Při reakci s Tollensovým činidlem využíváme redukci stříbrných iontů na stříbro (černé zrcátko), při Fehlingově, Benedictově či Barfoedově zkoušce dochází k redukci měďnatých iontů na červenohnědý oxid měďný (případně až na elementární měď), zatímco při Nylanderově zkoušce vzniká kovový bismut z bismutitých kationtů.
Patrně k nejdůležitějším aldehydům v těle patří sacharidy, proto byly výše zmíněné reakce používány zejména ke stanovení přítomnosti glukózy v moči. Dnes tuto úlohu převzaly metody specifičtější, a tak se s redukčními zkouškami (zejména Barfoedovou) setkáváme hlavně při screeningovému vyšetření vrozených vad metabolismu sacharidů (přítomnost redukujícího cukru v moči).
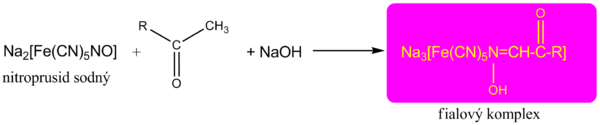
Průkaz ketonů
Ketoskupinu prokazujeme reakcí s nitroprusidem sodným (ať už při Legalově či Lestradetově zkoušce) v alkalickém prostředí, kdy vzniká červenofialový komplex.
Tato reakce se dodnes používá k průkazu ketolátek v moči.
Ketolátky vznikají při hladovění či u nekompenzovaných pacientů s cukrovkou, kdy je v buňkách nedostatek glukózy a energie se získává především odbouráváním tuků. Mezi ketolátky klinici počítají aceton, kyselinu acetoctovou a kyselinu β-hydroxymáselnou. Je třeba si však uvědomit, že kyselina β-hydroxymáselná mezi ketony z chemického hlediska nepatří (má hydroxy a karboxyskupinu, nikoli však ketoskupinu), a tak s nitroprusidem nereaguje. Negativní výsledek testu tak s jistotou nedokáže vyloučit ketoacidózu.
Karboxylové kyseliny
Karboxylové kyseliny jsou organické sloučeniny, charakterizované přítomností skupiny -COOH. Ve srovnání s kyselinami anorganickými patří spíše ke kyselinám slabším. Jejich síla (tj. ochota odštěpovat proton) je závislá na délce uhlíkatého řetězce (s délkou řetězce síla klesá) a na případných substituentech (např. přítomnost halogenu sílu zvyšuje – kyselina trichloroctová je mnohem silnější než kyselina octová). Karboxylové kyseliny (či jejich soli) jsou v lidském těle poměrně hojné.
Důležitými funkčními deriváty karboxylových kyselin jsou estery – sloučeniny vzniklé reakcí karboxylové kyseliny a alkoholu (či fenolu), které jsou velmi špatně rozpustné ve vodě. Esterifikace probíhá v kyselém prostředí (ideálně s kyselinou sírovou, která běh reakce podpoří i vázáním vznikající vody):
- R-COOH + R‘-OH → R-COOR‘ + H2O
Estery nižších či aromatických karboxylových kyselin s nižšími alkoholy mívají velmi výraznou vůni (často se používají jako esence – rumová, hrušková, ananasová, atd.). V biochemii nás však budou zajímat převážně estery složitější – tuky a vosky.
Chromatografie na tenké vrstvě
Chromatografie na tenké vrstvě patří mezi separační metody, oddělující látky ze směsi na základě odlišné afinity jednotlivých složek směsi ke stacionární a mobilní fázi.
U tenkovrstvé chromatografie je skleněná, hliníková nebo plastová deska potažena tenkou vrstvou stacionární fáze (silikagel, oxid hlinitý atd.), na kterou je nanášen analyzovaný vzorek. Látkové množství nanášeného vzorku by nemělo přesáhnout absorpční kapacitu stacionární fáze (je třeba optimalizovat množství vzorku a použitou tloušťku stacionární fáze).
Silikagel
Silikagel je forma oxidu křemičitého, u kterého jsou atomy křemíku mezi sebou navázány přes molekuly kyslíku. Směrem k povrchu destičky jsou na atomy křemíku navázány –OH skupiny. Celá struktura pak vypadá následovně:
Navázané –OH skupiny dávají povrchu destičky polární vlastnosti s možností tvorby vodíkových můstků a dalších nekovalentních interakcí se separovanými látkami.
Mobilní fáze
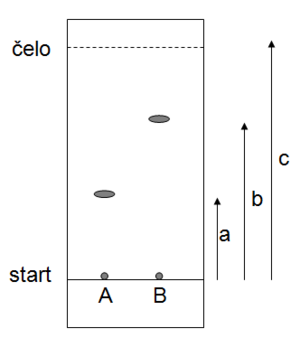
Mobilní fáze je specificky definovaná směs rozpouštědel, kterou nalijeme v malé vrstvě (do 1 cm sloupce kapaliny) do chromatografické vany. Poté do vany vložíme chromatografickou desku s naneseným vzorkem tak, aby vzorek byl nad hladinou rozpouštědla a aby se TLC deska opírala o stěnu pouze zadní stranou. Mobilní fáze vzlíná po desce směrem vzhůru a unáší s sebou i analyzovaný vzorek. Rychlost, kterou je vzorek unášen směrem vzhůru, závisí na rozpustnosti vzorku v mobilní fázi a na stupni interakce s fází stacionární (afinitě k stacionární fázi). Čím větší je afinita vzorku ke stacionární fázi, tím pomaleji stoupá vzhůru. Když rozpouštědlo dorazí dostatečně daleko od startu (většinou více než do ¾ desky), vyjmeme desku z chromatografické vany a pozici na desce, kam doputovalo rozpouštědlo, označíme čarou (= čelo).
Retenční faktor
Poté změříme vzdálenost jednotlivých látek od startu a pro každou látku vypočítáme takzvaný retenční (retardační) faktor Rf. Hodnota Rf udává, jak daleko zaostává skvrna analyzované látky za čelem rozpouštědla. Rf je pro danou látku v daném systému charakteristický, tzn., že pokud experiment zopakujeme, měli bychom ve stejném uspořádání získat stejný Rf. V našem případě bude pro látku A , pro látku B (viz obrázek).
Postup
V tomto praktickém cvičení budeme používat plastovou destičku potaženou silikagelem. Celý postup by měl probíhat kvůli organické mobilní fázi v digestoři. Na aktivní stacionární fázi nesaháme, při manipulaci s deskou používáme rukavice.
- Nalijeme rozpouštědlo do chromatografické vany, uzavřeme ji víkem a necháme chvíli ekvilibrovat. Výpary rozpouštědla by měly vysytit vnitřní prostor nad hladinou.
- Pipetou nebo stříkačkou naneseme vzorek na TLC desku a nanesenou směs necháme uschnout.
- Odklopíme víko a desku vložíme co nejrychleji dovnitř. Víko ihned zaklopíme.
- Kontrolujeme, aby se čelo rozpouštědla nedostalo až za horní hranu desky. V tom případě by část vzorku "vyjela" ven a nebylo by možné určit Rf.
- Analýzu ukončíme vyjmutím desky z chromatografické vany a označením čela analýzy.
Odkazy
Zdroj
- LENÍČEK, M. a L. MUCHOVÁ. Organika I. Návody pro praktická cvičení. 1. vydání. Praha. 2011.