Topologie DNA
In vivo dsDNA bývá převážně uzavřenou strukturou; virové, bakteriální a mitochondriální genomy jsou totiž často cirkulární molekuly a eukaryotické chromosomální DNA jsou složeny v kličky, jejichž konce jsou fixovány na proteinovém komplexu. Tyto uzavřené struktury dsDNA mohou být svinuty ve šroubovici druhého řádu nadšroubovici. Posuzujeme–li konformaci DNA na tomto stupni struktury, mluvíme o topologii DNA.
Vinutí helixu[upravit | editovat zdroj]
Pokud je jeden konec lineární pravotočivé dvoušroubovice fixován a druhý rotuje tak, aby se vinutí helixu „utahovalo“, tedy proti směru hodinových ručiček, stáčí se DNA do pozitivní (levotočivé) nadšroubovice (superhelixu). Rotací fixované dsDNA ve směru hodinových ručiček se může stočit v negativní nadšroubovici, která se v buňkách běžně vyskytuje. Energie uložená v negativní nadšroubovici usnadňuje rozvinování řetězců dsDNA při replikaci. Při ní se parentální dsDNA otáčí proti směru hodinových ručiček a negativní nadšroubovice se rozplétá. Tento jev lze dobře demonstrovat na rotaci a svinování delší a silnější gumy.
Číselný popis vinutí[upravit | editovat zdroj]
Změny topologických (a energetických!) stavů DNA se vyjadřují číselně:
- Celkové číslo vinutí L (linking number) udává, kolikrát se v posuzované struktuře vine jeden řetězec DNA kolem druhého, bez ohledu, zda–li ve šroubovici nebo nadšroubovici.
- Dvoušroubovicové číslo T (twisting number) je počet otáček řetězců v helixu.
- Nadšroubovicové číslo W (writhing number) udává, kolikrát se kříží dvoušroubovice jako celek.
Z toho vyplývá, že L = T + W. Molekuly DNA, které se liší pouze v čísle L, jsou topoizomery. Prakticky se posuzují spíše změny v křížení, než jejich absolutní počet, tedy AL, AT, AW.
Topoizomerázy[upravit | editovat zdroj]
Topoizomerázy jsou enzymy, které nadšroubovici zavádějí nebo ji naopak ruší.
Topoizomeráza I[upravit | editovat zdroj]
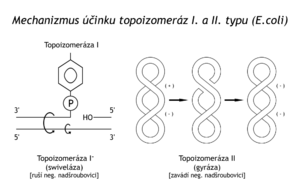
- Topoizomerázy I. typu vytvoří zlom na jednom z řetězců, při čemž se 5'–konec zlomu váže na skupinu –OH tyrosinového zbytku enzymu. Případné pnutí v nadšroubovici se uvolní otáčením helixu kolem s–vazeb neporušeného řetězce. Pak enzym bez dodání energie přerušený řetězec opět zcelí. Energie pro znovunavázání řetězce se zachovala ve vazbě 5'–konec zlomu na enzym. Topoizomerázy I byly popsány v baktériích i živočišných buňkách. Příkladem budiž ω–protein čili swivelasa v E. coli (swivel = obrtlík). Topoizomerázy I ruší negativní nadšroubovici.
Topoizomeráza II[upravit | editovat zdroj]
- Topoizomerázy II.typu štěpí najednou oba řetězce dsDNA, místem přerušení přemístí jiný, neporušený úsek dsDNA na druhou stranu helixu a oba řetězce opět zcelí.
Příkladem těchto enzymů je gyráza v baktérii E. coli. Určitý stupeň supersvinutí DNA, potřebný k rozvinování dvoušroubovice, je tedy v buňce zajištěn protichůdně působícími enzymy: topoizomeráza I rozvinuje negativní nadšroubovici, gyráza ji naopak zavádí.
Negativní nadšroubovice má vyšší volnou energii než relaxovaná dsDNA. Gyráza tuto energii získá štěpením ATP.
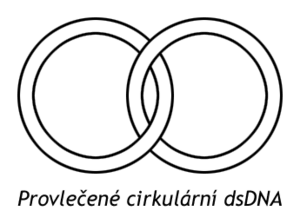
Navazování řetězců DNA na enzym je inhibováno kyselinou nalidixovou (antibiotikum), a navazování ATP je rušeno antibiotikem novobiocinem. Zaváděním negativní nadšroubovice topoizomerázy II. typu napomáhají rozvinovat helix DNA v replikační vidlici. Katalyzují též uvolnění provlečených cirkulárních dsDNA vzniklých po replikaci virového genomu.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
- Struktura nukleových kyselin
- Základní složky nukleových kyselin
- Primární struktura nukleových kyselin
- Štěpení nukleové kyseliny hydrolýzou
- Metody sekvencování
- Sekundární struktura DNA
- Denaturace nukleových kyselin, molekulární hybridizace
- Sekundární struktura RNA
- Interakce DNA s proteiny
- Bakteriální chromozom
- Eukaryotické chromosomy
- DNA mitochondrií
Zdroje[upravit | editovat zdroj]
- ŠTÍPEK, Stanislav. Stručná biochemie : Uchování a exprese genetické informace. 1. vydání. Medprint, 1998. 92 s. s. 19–20. ISBN 80-902036-2-0.