Reprodukce RNA virů
Hostitelská buňka nemá enzymy pro syntézu polynukleotidového řetězce na matrici RNA. Proto RNA viry musí obsahovat informaci pro syntézu zvláštní polymerázy, buď RNA-dependentní RNA-polymerázy nebo RNA-dependentní DNA-polymerázy. Virion někdy musí být vybaven již hotovou takovouto polymerázou.
Genová exprese virové RNA má různou strategii, podle které lze viry rozdělit do několika tříd:
První třída RNA virů[upravit | editovat zdroj]
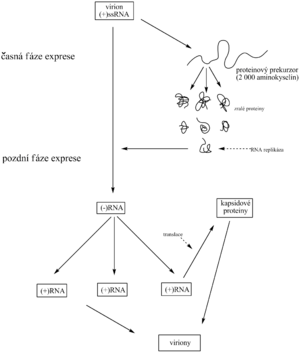
Do první třídy RNA virů patří picornaviry (pico = malý), včetně polioviru, původce dětské přenosné obrny, a arboviry (arthropode bone = přenášený členovci) včetně původce klíšťové encefalitidy. Virion této třídy obsahuje (+)ssRNA. Nejdříve se na hostitelských ribosomech podél této mRNA syntezuje obrovský proteinový prekurzor (řetězec asi o 2000 aminokyselinových zbytcích), který se pak rozštěpí na 7 proteinů. Některé z nich jsou kapsidové bílkoviny a jeden štěp je RNA-dependentní RNA-polymeráza (RNA replikáza). Tento enzym na templátu virionové (+)RNA katalyzuje syntézu řetězce (-)RNA a ten použije jako templát k pomnožení (+)RNA, tedy genomů, jež se vestaví do nových virových částic.
Na rozdíl od bakterií eukaryotická hostitelská buňka je schopna překládat mRNA (i polygenovou!) pouze do jediného polypeptidového řetězce. Proto virus využívá k tvorbě svých jednotlivých proteinů eukaryotickou posttranslační proteolýzu. S podobným mechanismem se setkáváme např. při biosyntéze některých peptidových hormonů (ACTH, endorfiny).
Druhá třída RNA virů[upravit | editovat zdroj]
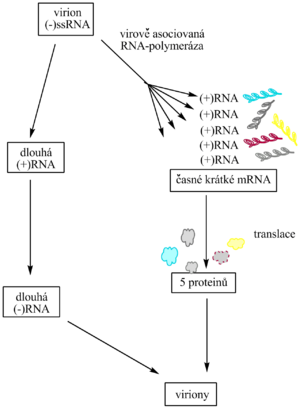
Druhá třída zahrnuje viry, obsahující v částici (-)ssRNA. Patří sem rhabdoviry (rhabdos = hůl, tyčka), jako je původce vztekliny, chřipkové viry, virus příušnic a virus spalniček. Tentokrát je při expresi viru řešena skutečnost, že genomová RNA je řetězec (-), nepoužitelný jako mRNA, a že hostitelská buňka nemá enzym replikující (-)RNA. Virion však obsahuje RNA-dependentní RNA-polymerázu (replikázu), která nejdříve na virové genomové matrici syntetizuje pět krátkých mRNA. Ty pak na ribosomech řídí syntézu 5 proteinů (včetně kapsidového, plášťového a včetně nové replikázy, která katalyzuje vznik nové úplné (dlouhé) virové (+)RNA a virionové (+)RNA). Tak je vše připraveno k sestavování virionů. U této druhé třídy RNA virů je problém, jak získat z polygenové informace jednotlivé peptidy, řešen na úrovni transkripce. Syntetizují se krátké mRNA, nevzniká proteinový prekurzor, který by bylo nutno posttranslačně upravovat jako při reprodukci virů I. třídy.
Třetí třída RNA virů[upravit | editovat zdroj]
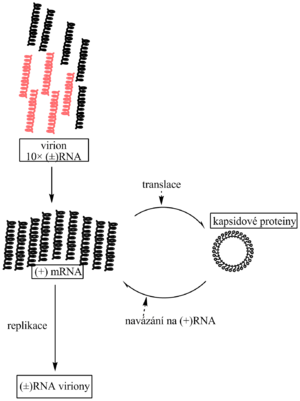
Třetí třídu tvoří reovirus. Byl nalezen v lidském respiračním a zažívacím traktu, i když nezpůsoboval zjevné onemocnění (respiration and enteric orphans). V jeho virionu se nachází deset (±)dsRNA a RNA-dependentní RNA-polymeráza, která v hostitelské buňce použije (-) řetězce virové RNA jako matrici k syntéze deseti mRNA. Jejich translací vzniká 10 virových proteinů včetně nové replikázy. Replikací se posléze rozmnoží a vytvoří též genomové (±)dsRNA. Jednotlivé složky se sestavují v nové viriony. Genom reoviru tedy obsahuje 10 monogenových mRNA.
Čtvrtá třída RNA virů[upravit | editovat zdroj]
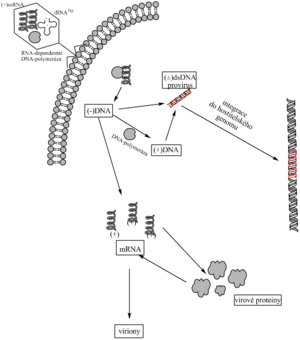
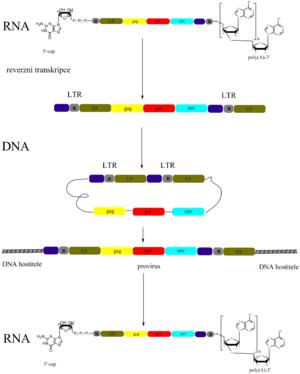
Do čtvrté třídy se řadí retroviry (např. virus Rousova sarkomu – původce ptačího sarkomu nebo virus HIV – původce AIDS). Název vyjadřuje zvláštní strategii replikace těchto virů, t.j. reverzního převodu informace z RNA do DNA. Virion viru Rousova sarkomu (RSV) obsahuje 2 molekuly (+)ssRNA, RNA-dependentní DNA-polymerázu (reverzní transkriptázu) a tRNATrp. Tyto složky jsou obaleny kapsidovými proteiny a lipidovou membránou obsahující virový glykoprotein.
Po vniknutí viru do buňky RNA-dependentní DNA-polymeráza v cytosolu přepíše virový genom do řetězce (-)DNA a hned ho doplní na (±)dsDNA zvanou provirus. Jako primer při syntéze DNA slouží virionová tRNATrp, která byla v předešlém cyklu převzata od hostitelské buňky a asociovala se na krátký komplementární úsek virové RNA. Templátová (virionová) RNA je během syntézy proviru rozložena.
Retrovirová DNA je transkribována jedině tehdy, je-li začlenena (integrována) do hostitelského genomu. K tomu slouží dlouhé koncové repetice (LTR, long terminal repeats) na obou koncích provirové DNA. Zahrnují úsek U3, R a U5. U5 a U3 jsou rozdílné sekvence, R je repetice. V LTR jsou signální sekvence pro integraci a transkripci (enhancery, promotory).
(±)dsDNA RSV se nejdříve cyklizuje a pak se přemístí z cytosolu do jádra. Začlení se (integruje) na zcela určité místo ptačího genomu (je schopna se integrovat i do savčího genomu, a to na různá místa).
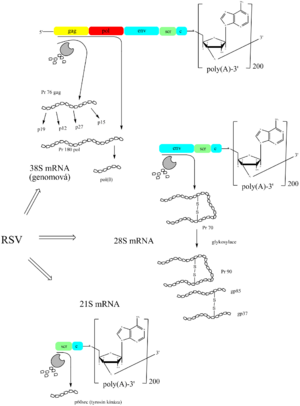
Genom RSV obsahuje čtyři geny. Gen gag kóduje velký proteinový prekurzor (polyprotein), ze kterého se pak proteolyticky oddělí několik virových proleinů. Gen pol nese informace pro syntézu reverzní transkriptázy a gen env pro vznik virového obalového glykoproteinu. Z lékařského hlediska je zajímavý gen src, který není pro reprodukci viru nutný, avšak jeho produkt vyvolává malignizaci buňky (fibroblast mění v sarkomovou buňku). Proto je řazen do skupiny tzv. onkogenů. Kóduje proteinkinázu, která katalyzuje fosforylaci tyrosinového zbytku jiných proteinů. Mechanismus, jakým tento enzym vyvolá maligní zvrat, není zcela objasněn.
Při expresi genomu RSV se alternativním sestřihem syntetizují tři různé mRNA. Nesestřižená mRNA se stane genomovou, je asociována s virovými proteiny a tRNA. Hotový virion „vypučí“ z cytoplazmatické membrány hostitelské buňky, přičemž si odejme část této membrány, aniž by buňku lyzoval. Tím se retroviry liší od DNA virů. Retrovirová DNA se replikuje s hostitelským genomem, takže virus se přenese do dceřiných buněk.
Na chromosomech zdravého kuřete byl nalezen gen, lišící se strukturou jen nepatrně od virového src. Ukázalo se, že je to normální buněčný gen odpovědný za diferenciaci buňky. Obecně se nazývá protoonkogen a je označován jako c-src na rozdíl od virového onkogenu v-src. Byly již objeveny desítky takovýchto protoonkogenů. Podle názoru vědců byl onkogen přenesen do virového genomu sekundárně a je jím přenášen z buňky na buňku (transdukce). Jeho exprese je pak řízena virovým promotorem, který nepodléhá normálním regulacím, takže není zaručena fyziologická hladina jeho produktu. Některé virové promotory jsou velice výkonné. Virové onkogeny nemají introny, na rozdíl od buněčných protoonkogenů.
Retrovirové onkogeny[upravit | editovat zdroj]
Retrovirové onkogeny lze podle jejich produktů rozdělit do pěti skupin:
- Onkogeny, které kódují tyrosinovou proteinkinázu (např. src).
- Onkogeny kódující bílkovinu s funkcí růstového faktoru (např. onkogen sis kóduje protein téměř identický s růstovým faktorem PDGF).
- Onkogeny s informací pro syntézu receptorů růstových faktorů (např. onkogen erb-B).
- Onkogeny řídící vznik proteinů vázajících guanylnukleotidy, tj. G-proteiny (např. onkogen Ha-ras). Takové produkty pak nejsou schopny štěpit GTP, což poruší regulační vlastnosti G-proteinu a způsobí malignizaci buněk.
- Onkogeny kódující jaderné regulační proteiny (např. onkogen myb).
Z rozmanitosti produktů onkogenů vyplývá, že mechanismy onkogeneze jsou různé, neboť tyto proteiny zasahují do různých stupňů regulace buněčné diferenciace a proliferace. Onkogen Erb-B např. produkuje pouze tyrosinkinázovou část membránového receptoru pro epidermální růstový faktor EGF. Na normálním rcceptoru je tyrosinkináza aktivní pouze po navázání EGF na receptor. Produkt onkogenu Erb-B však tuto vazebnou část postrádá a kinázová aktivita je konstitutivně odblokována.
Virus Rousova sarkomu byl příkladem tzv. akutně transformujícího viru. Patří sem též akutní leukemické viry. In vitro jsou takovými viry buňky transformovány během 2–3 týdnů. Onkogen je v tomto případě vložen do virového genomu a jeho transkripce je řízena virovým promotorem. Existuje ještě skupina pomalu transformujících virů (např. chronické leukemické viry), které transformaci buněk navodí až po 4–12 měsících. Genomy těchto virů neobsahují onkogen. Buňku malignizují až tehdy, jsou-li integrovány v sousedství normálního buněčného protoonkogenu, který je pak řízen výkonným provirovým promotorem.
Některé retroviry jsou nebezpečné, aniž by navozovaly maligní zvrat. Virus lidské imunodeficience (HIV, human imunodeficiency virus) vyvolává syndrom získané imunitní nedostatečnosti (AIDS, acquired immune deficiency syndrome). Virus je příbuzný lymfotropnímu viru, který u člověka vyvolává vzácně leukémii (HTLV-I). Virus HIV infikuje lymfocyty T4 a lyzuje je. Tím organismus ztrácí důležitou složku imunitní obrany. Lymfocyty T4 jsou totiž potřebné k uchování paměti pro sekundární imunitní odpověď, mají význam při zrání B-buněk v plazmatické buňky, produkující protilátky a pro zrání lymfocytů T8, potřebných k odstraňování infikovaných buněk. Člověk umírá na běžnou infekci nebo na maligní nádor.
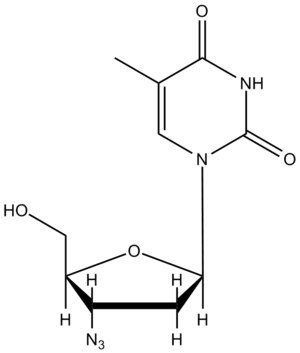
Intenzivní studie tohoto viru zatím nepřinesly výsledky, umožňující účinnou terapii. Thymidinazid je reverzní transkriptázou zařazen do provirové DNA a ukončuje prodlužování řetězce, který postrádá volnou 3'-OH skupinu. Lék zpomaluje onemocnění.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
Zdroj[upravit | editovat zdroj]
- ŠTÍPEK, Stanislav. Stručná biochemie : uchování a exprese genetické informace. 1. vydání. Praha : Medprint, 1998. ISBN 80-902036-2-0.
Použitá literatura[upravit | editovat zdroj]
- ŠTÍPEK, Stanislav. Stručná biochemie : uchování a exprese genetické informace. 1. vydání. Praha : Medprint, 1998. ISBN 80-902036-2-0.