Translace u prokaryot
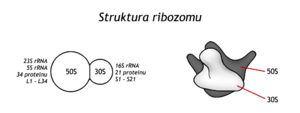
Struktura ribosomů[upravit | editovat zdroj]
Bakteriální ribosom byl první buněčnou organelou podrobně popsanou na molekulární úrovni. Ribosom E. coli je ribonukleoproteinová částice (70S, Mr = 2,5 milionu), skládající se z jedné menší (30S) a z jedné větší (50S) podjednotky. Menší podjednotka obsahuje jednu molekulu ribosomální RNA (16S rRNA) a 21 molekul proteinů, označovaných S1, S2,…S21 (angl. small=malý). Větší podjednotka (50S) se u bakterií skládá ze dvou rRNA (23S a 5S) a 34 proteinů (angl. large = velký, proto L1, L2,…L34). Většina proteinů je v částici zastoupena jednou molekulou. Složky ribosomálních podjednotek jsou uspořádány tak, aby organela mohla plnit vazebné, katalytické a regulační funkce a aby mohla měnit konformaci a posunovat molekulu mRNA. Větší podjednotka tvarem připomíná křeslo, menší je oválná.
Iniciace translace[upravit | editovat zdroj]
Syntéza peptidového řetězce je u bakterií zahajována vytvořením iniciačního komplexu, skládajícího se z podjednotky 30S, mRNA a iniciační aa–tRNA, což u bakterií je N–formylmethionyl–tRNA (fMet–tRNAiMet). Tato aa–tRNA se váže na mRNA s iniciačním kodonem AUG (někdy též GUG, čteným jako signál pro Met). Na mRNA byl objeven úsek před iniciačním kodonem (Shineova–Dalgarnova sekvence), který je komplemetární k 3’–konci 16S rRNA. Asociace mRNA s 16S rRNA přispívá ke správné lokalizaci mRNA na ribosomu.
Iniciační komplex se tvoří tak, že na podjednotku 30S se nejdříve navážou proteinové iniciační faktory IF1, IF2 a IF3. Připojení GTP k IF2 umožní vazbu tohoto komplexu s mRNA a iniciační Met–tRNA. Vznikne iniciační komplex 30S.IF3.mRNA.IF1.IF2.fMet–tRNA.GTP. K němu se pak naváže ribosomální podjednotka 50S. Současně se uvolní faktory IF1, IF2, IF3 a hydrolyzuje se GTP na GDP a fosfát.
fMet–tRNAiMet obsadí na ribosomu tzv. peptidylové místo P. Další, aminokyselinové místo A, je určeno k vazbě další aa–tRNA, odpovídající kodonu následujícímu za AUG.
Methionin je formylován transformylasou za účasti N10–formyltetrahydrolistové kyseliny a to až po navázání aminokyseliny na iniciační tRNAf Met–tRNAm, zařazující methionin dovnitř peptidového řetězce, je poznávána též kodonem AUG, při translaci se váže na aminokyselinové místo ribosomu a není formylována. Popsaná modifikace iniciační Met–tRNA není známa u eukaryot.
Elongace peptidu[upravit | editovat zdroj]
Prodlužování syntézovaného peptidu probíhá ve třech krocích:
1.fáze: Navázání další aa–tRNA na aminoacylové místo ribosomu. Tato aminoacyl–tRNA je vybrána kodonem nacházejícím se v tomto místě. Na ribosom je dopravena v komplexu s proteinovým elongačním faktorem EF–Tu, vázajícím GTP. Při předání aa–tRNA se GTP hydrolyzuje a EF–Tu se uvolní z ribosomu. Na EF–Tu.GDP se připojí elongační faktor EF–Ts a změní konformaci komplexu natolik, že se GDP uvolní. Regenerovaný EF–Tu může po vazbě s novým GTP vstoupit do dalšího cyklu. EF–Tu nereaguje s f–Met–tRNAiMet. Proto se tato aa–tRNA nenavazuje na aminoacylové místo. EF–Tu však váže Met–tRNA a zajišťuje tak zařazení methioninu dovnitř řetězce.
Při hydrolýze GTP a uvolňování EF–Tu–GDP z ribosomu se konformace faktoru mění v blízkosti právě navázané aa–tRNA natolik, že jen aa–tRNA pevně a přesně vázaná na antikodon a aminoacylové místo se neuvolní. Pokud je omylem zařazena nesprávná aa–tRNA se slabšími vazbami, je v této fázi translace opět uvolněna. Faktor EF–Tu udává rychlost (krok) celé translaci.
Protein EF–Tu patří do velké a fylogeneticky staré rodiny proteinů G, které jsou mimo jiné součástí mechanismu hormonální regulace.
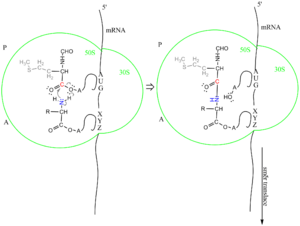
2.fáze: Tvorba peptidové vazby (transpeptidace). Vznik peptidové vazby je katalyzován peptidyltransferasou, která je součástí podjednotky 50S. V podstatě jde o nukleofilní ataku skupiny dusíku 2–NH2 skupiny připojované aminokyseliny (aa–tRNA na místě A) na karboxylový uhlík f–Met–tRNAiMet nebo peptidyl–tRNA, nacházející se na místě P. Mezi zúčastněnými aminokyselinami se vytvoří peptidová vazba a zároveň se rozštěpí esterová vazba mezi aminokyselinou a tRNA na místě P. Na místě A tak vznikne peptidyl–tRNA. Jinak řečeno, peptidyl se přenese z předchozí tRNA na skupinu NH2 následující aa–tRNA, čímž se řetězec prodlouží o jednu aminokyselinu. Z toho vyplývá, že peptidový řetězec roste od N–konce k C–konci.
3.fáze: Translokace je pochod, při kterém se volná tRNA z peptidylového místa uvolní a mRNA se posune o 3 nukleotidy (o jeden kodon), takže peptidyl–tRNA se dostane z místa A na místo P. K posunu je třeba elongační faktor EF–G s navázaným GTP, který patří mezi zmíněné proteiny G jako EF–Tu. Hydrolýzou GTP se EF–G z ribosomu uvolní. Na volné místo A se může navázat další aa–tRNA a cyklus se opakuje. Tímto způsobem se mRNA posunuje po ribosomu, z něhož se zároveň odvíjí rostoucí polypeptidový řetězec.
Terminace translace[upravit | editovat zdroj]
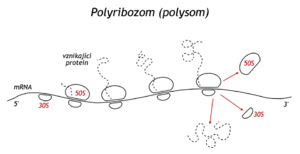
Ribosom se během syntézy polypeptidu posune k terminátoru, tj. kodonu, signalizujícímu ukončení translace. Je to kodon UAG,UAA nebo UGA. Žádný z nich nekóduje zařazení nějaké aminokyseliny do peptidu, tyto kodony rozpozná některý z proteinových uvolňovacích terminačních faktorů (releasing factors). Faktor RF1 pozná UAA a UAG, RF2 pak UGA a UAA. Po navázání faktoru na ribosom se peptidyl–tRNA přesune z místa A na místo P. Specifita peptidyltransferasy se změní natolik, že přepojí peptidyl na molekulu vody místo na 2–NH2 další aa–tRNA. Jinak řečeno, hotový peptid se hydrolyticky uvolní od poslední tRNA. Uvolní se tRNA a mRNA a ribosom se rozpadne na podjednotky 50S a 30S. Iniciační faktor IF3 se ihned naváže na 30S a tak zabrání reasociaci ribosomu, který by byl nefunkční, neboť neobsahuje mRNA. Jednotlivé složky se mohou účastnit tvorby nového iniciačního komplexu a zahájit nový cyklus. Na jediné mRNA je simultánně navázáno několik ribosomů, které po řetězci mRNA postupují v určitém odstupu a na každém z nich probíhá syntéza jednoho peptidu. Celý útvar se nazývá polyribosom, též polysom. Tímto způsobem se mRNA využívá velmi efektivně.
Inhibitory bakteriální translace[upravit | editovat zdroj]
Řada antibiotik používaných v lékařské praxi i pro výzkumné účely inhibuje některou fázi translace.
Streptomycin brání v navázání fMet–tRNAiMet na 30S–podjednotku ribosomu a znemožňuje zahájení translace. Kromě toho je příčinou chybného čtení genetického kódu.
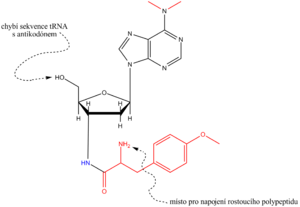
Tetracyklin se též navazuje na podjednotku 30S a inhibuje připojení aa–tRNA na místě A. Běžně užívaný chloramfenikol inhibuje bakteriální peptidyltransferasu (toxický cykloheximid působí analogickým způsobem na eukaryotickou translaci). Erytromycin zastavuje translaci tím, že se připojuje na podjednotku 50S. Uvedená antibiotika se užívají k léčení bateriálních infekcí, zatímco puromycin je s úspěchem používán k vědeckým účelům, ke studiu mechanismu proteosyntézy. Svou strukturou imituje 3'–konec tyrosinyl–tRNA. Methyltyrosinyl je v puromycinu vázán pevnou amidickou, nikoli esterovou vazbou a molekula nemá antikodon. Na místě A se rostoucí peptid přenese na puromycin a výsledný peptidyl–puromycin se z ribosomu uvolní. Syntéza peptidu je tak předčasně přerušena.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
Zdroje[upravit | editovat zdroj]
- ŠTÍPEK, Stanislav. Stručná biochemie : Uchování a exprese genetické informace. 1. vydání. Medprint, 1998. 92 s. s. 45–49. ISBN 80-902036-2-0.