Řízení genové exprese a proteosyntézy u prokaryot
Molekulární podstata bakteriální regulace genové exprese byla poznána dříve a podrobněji než eukaryotická regulace, protože bakteriální systémy jsou jednodušší a protože bakterie mají krátký buněčný cyklus, což genetické studie podstatně urychluje. U prokaryot převažuje regulace na úrovni transkripce.
Regulace na úrovni transkripce[upravit | editovat zdroj]
Regulace σ-faktory[upravit | editovat zdroj]
Promotor je úsek DNA, na kterém RNA-polymerasa začíná syntetizovat řetězec RNA. Jedna z podjednotek bakteriální RNA-polymerasy je σ-faktor, bez kterého enzym nerozezná promotor. Různé typy σ-faktorů umožňují polymerase určit různé promotory. Faktory se označují podle molekulové hmotnosti. Za optimálních podmínek v bakterii působí σ70. Při tepelném šoku se syntetizují jiné bílkoviny, vlivem faktoru σ32. Při infekci fágem se v bakterii uplatní σ, který pomáhá zahájit transkripci tzv. pozdních genů. σ37 zahajuje transkripci sporulačních genů. Nemá-li bakterie v živné půdě dostatek dusíkatých látek, σ60 zajistí využití jiných zdrojů.
Jacobův-Monodův operonový model[upravit | editovat zdroj]
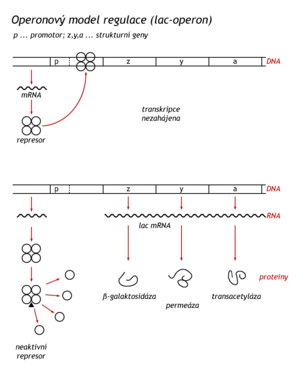
V r.1961 Francouzi Jacob a Monod zveřejnili teorii, vykládající mechanismus, jakým bakterie mění spektrum syntezovaných enzymů v závislosti na druhu živných látek, které má k dispozici. Tato teorie regulace transkripce se plně potvrdila. Základní regulovanou jednotkou na DNA je operon. Skládá se z operátoru a z tandemově uspořádaných strukturních genů. Operátor je sekvence DNA, na kterou se váže protein zvaný represor.
K využití laktózy jako zdroje energie bakterie potřebuje enzymy β-galaktosidasu, galaktosidpermeasu a β-galaktosidtransacetylasu, které jsou kódovány laktosovým operonem (lac-operon). E. coli pěstovaná na půdě s výhodnými energetickými zdroji, tj. glukózou nebo glycerolem, uvedené enzymy nepotřebuje. Za těchto okolností jsou v buňce zastoupeny jen několika molekulami. Jestliže je E.coli přenesena na živnou půdu, ve které bude místo zmíněných energetických zdrojů laktosa, indukuje se v bakterii syntéza enzymů potřebných k jejímu využití. Proto se nazývá inducibilní enzymy. Přirozeným induktorem je 1,6-allolaktosa, která z laktosy vzniká transglykosylací, kterou katalyzuje oněch několik perzistujících molekul β-galaktosidasy.
Když byla objevena konstitutivní mutanta, která syntezovala všechny tři zmíněné enzymy bez ohledu na dostupné sacharidy, Jacob a Monod předpověděli, že syntézu všech tří enzymů řídí jediný regulační gen, jehož difuzibilní produkt (proteinový represor) se naváže na operátor a zabrání syntéze polygenové (polycistronické) mRNA. Dnes víme, že na tuto mRNA se ještě během transkripce navazují ribosomy a translační faktory a syntetizují se jednotlivé enzymy, nikoli proteinový prekurzor odpovídající celému operonu. Syntéza dlouhých proteinových prekurzorů a jejich proteolytické štěpení ve funkční peptidy je jev pozorovaný v eukaryotických buňkách.
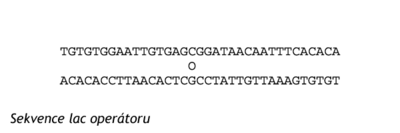
Lac represor (Mr=37000) se skládá ze čtyř identických podjednotek. Tetramer má vysokou afinitu k operátoru, na který se naváže a zastaví transkripci operonu. Po navázání čtyř molekul induktoru se represor disociuje na podjednotky a uvolní se z DNA. Může být zahájena syntéza mRNA a enzymů. Pro represory je charakteristická vysoká afinita k operátorům. Disociační konstanta lac-represor-operátorového komplexu je 10 M. Represor se nejdříve naváže na nespecifické místo DNA a putuje po DNA. Vyhledává tedy operátor jednorozměrově, podél DNA. Navazování represoru třírozměrově, přímo z roztoku, by bylo zdlouhavé. Sekvence operátoru (27 pb) je centrálně symetrická, což je běžné v úsecích DNA určených pro specifické navázání proteinů.
Regulační význam cAMP u bakterií[upravit | editovat zdroj]
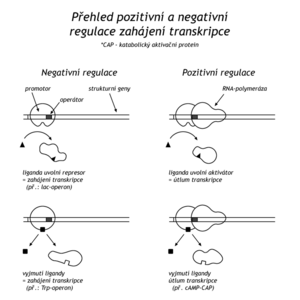
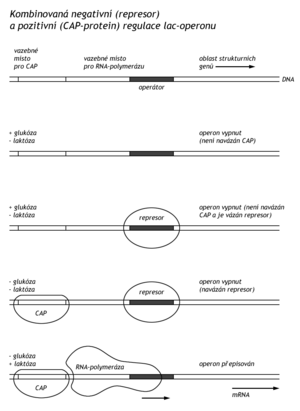
Regulace na laktosovém operonu je příkladem negativní regulace transkripce, což znamená, že geny jsou přepisovány, dokud transkripce není zastavena represorovým proteinem. Při pozitivní regulaci jsou geny aktivní pouze tehdy, je-li regulační protein navázán na DNA. Příkladem pozitivní regulace je katabolická represe. Pokud má E.coli k dispozici glukózu, je v bakterii nízká hladina nejen β-galaktosidasy, ale též dalších katabolických enzymů (galaktokinázy, tryptofanasy, arabinoisomerasy). V nepřítomnosti glukózy stoupne v buňce koncentrace cAMP, který se naváže na katabolicky aktivační protein (CAP-protein, catabolite activating protein). Komplex CAP-cAMP má vysokou afinitu k části promotorů jednotlivých genů několika katabolických enzymů. Komplex se navazuje tak, že na rozdíl od represoru nepřesahuje vazebné místo pro RNA-polymerasu, spíše vytvoří další vazebná místa a tím stimuluje transkripci.
V místě zahájení transkripce laktosového operonu tedy působí dva regulační mechanismy. Represor se zahájením transkripce interferuje, CAP-cAMP ho usnadňuje. Pokud je v prostředí glukóza i laktosa, bakterie dá přednost glukóze, neboť vlivem glukózy poklesne hladina cAMP v buňce a dereprese laktosového operonu není stimulována pro nedostatek CAP-cAMP.
Variace operonového řízení genů. Tryptofanový a arabinosový operon[upravit | editovat zdroj]
Tryptofanový operon řídí syntézu pěti enzymů potřebných k tvorbě tryptofanu z chorismátu. Represor tryptofanového operonu se na rozdíl od laktosového represoru může navázat na operátor teprve v komplexu s korepresorem, což v tomto případě je tryptofan. Jen v tomto komplexu zaujímá represor konformaci s vysokou afinitou k operátoru. Je to účelné, neboť je-li v prostředí dostatek Trp, nemá bakterie důvod syntetizovat enzymy k jeho tvorbě. Při nedostatku tryptofanu se komplex Trp-represor-operátor disociuje a tím se odblokuje syntéza polycistronické mRNA.
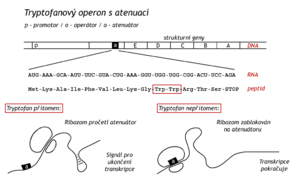
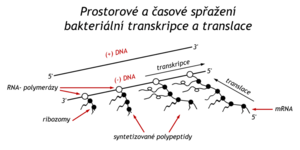
Laktosový represor řídí expresi jediného operonu, zatímco tryptofanový represor ovládá funkci tří operonů. Řídí zmíněný Trp-operon (5 enzymů), další operon pro tři enzymy biosyntézy aromatických aminokyselin a kromě toho reguluje svou vlastní tvorbu na regulačním genu. Při studiu Trp-operonu byla objevena ještě další hladina regulace transkripce, atenuace (angl.attenuate = zmírnit). Regulační signál v tomto případě pochází z translační úrovně proteosyntézy. V bakterii je to umožněno tím, že transkripce a translace jsou zde svázány místně i časově.
Atenuátor je úsek DNA mezi operátorem a genem pro první ze skupiny enzymů. Kóduje vedoucí sekvenci mRNA na jejím 5’-konci. Tato sekvence je ribosomem překládána v peptid na jehož 10. a 11.pozici jsou tryptofany. Čtrnáctým kodonem vedoucí sekvence je kodon-terminátor. Je-li v prostředí dostatek Trp, ribosomy se „pročítají“ k terminačnímu kodonu a začátek mRNA se konformuje do tvaru signalizujícího ukončení syntézy překládané (a ještě nedokončené) mRNA. Na konci atenuátoru se totiž vytvoří vlásenka mRNA, která je terminátorem pro RNA-polymerasu. Za nedostatku Trp se ribosom zastaví u kodonů pro Trp a 5’-konec mRNA s ribosomem vytvoří takovou konformaci, která znemožňuje tvorbu terminátoru pro RNA-polymerasu. Transkripce pokračuje. Je to logické, bakterie potřebuje enzymy k syntéze Trp. Atenuace je známa u řady dalších operonů (pro enzymy syntézy Phe, His aj.)
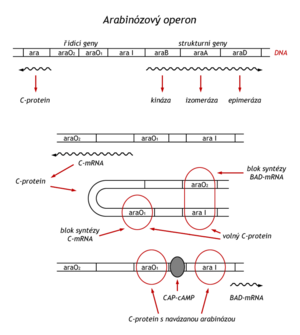
Některé proteiny mohou být pozitivními i negativními regulátory. Takový represor ovládá např. arabinosový operon, který řídí syntézu tří enzymů, přeměňujících arabinosu na xyluloso-5-fosfát (araB, araA, araD). V tomto případě regulační gen C sousedí s operonem, a ten má dva operátory (ara O1 a ara O2) a jeden promotor (ara 1). Jako katabolický operon je arabinosový operon řízen též komplexem cAMP-CAP, usnadňujícím zahájení transkripce. Mohou nastat tři situace:
- Při nedostatku regulačního proteinu C je syntezována mRNA pro jeho syntézu.
- Syntéza proteinu C je autoregulována. Při nadbytku proteinu C v nepřítomnosti arabinosy se protein C naváže současně na operátor O2 a další molekula proteinu C na operátor O2 a úsek aral, což je promotor strukturních genů. Vytvoří se klička DNA a syntéza enzymů je blokována.
- Jestliže při nedostatku glukózy stoupne hladina cAMP v buňce a v prostředí je arabinosa, naváže se arabinosa na protein C. Tím ho konformačně změní v pozitivní regulační faktor, který spolu s komplexem cAMP-CAP umožní zahájit syntézu mRNA pro syntézu enzymů. Syntéza proteinu C je při tom stále blokována komplexem arabinosa-protein C navázaným na operátor O1.
Jsou známy ještě složitější regulační systémy, ve kterých je programově postupně aktivován jeden gen za druhým v určitém sledu a po dosažení určitých podmínek. Tak tomu je např. po infekci buňky virem (fágem). V první fázi infekce hostitelská buňka syntezuje faktory a enzymy pro syntézu virových složek, a v pozdní fázi infekce se program změní ve prospěch syntézy vlastních komponent virionu. Podrobně byl takový program prostudován např. u fága λ. Program je to nadmíru účelný, vždyť virus „smí“ svého hostitele zabít až po využití jeho proteosyntetických mechanismů.
Řízení terminace transkripce[upravit | editovat zdroj]
Při transkripci se RNA-polymerasa pohybuje po DNA až k terminátorové sekvenci. Po jejím přepisu se syntezovaná RNA stočí do vlásenky, která napomáhá disociaci RNA od matrice a uvolnění enzymu. Za vlásenkou bývá úsek oligo(U), který se k matrici váže slaběji než sekvence ohsahující G a C. Existují proteiny zvané antiterminační faktory, které umožní, aby se enzym „pročetl“ přes terminátorovou sekvenci a pokračoval v syntéze delší RNA.
Terminace transkripce by mohla být řízena také hladinou ρ-faktoru (rhó-faktoru). Je to protein, určitá jehož koncentrace je třeba k zakončení transkripce na některých terminátorech. Tato pozorování zatím nebyla potvrzena in vivo.
Regulace bakteriální proteosyntézy na úrovni translace[upravit | editovat zdroj]
U bakterií je známa translační represe. Příkladem je syntéza ribosomálních proteinů. Syntéza padesáti těchto bílkovin je přesně koordinována na 20 operonech. Na každém operonu je syntezována polycistronická mRNA kódující určitou skupinu ribosomálních proteinů a někdy i dalších bilkovin (EF-G, EF-Tu, podj. RNA-polymerasy). Ve skupině bývá vždy jeden z proteinů represorem translace. Navazuje se na mRNA (nikoli DNA!) a potlačuje syntézu celé skupiny proteinů, zakódovaných na molekule mRNA. Této regulaci je nadřazena syntéza rRNA. Afinita ribosomálních proteinů k rRNA je vyšší než k vazebnému místu na mRNA. Dokud je tedy dostatek rRNA, syntezují se další ribosomální proteiny. Jestliže je syntéza rRNA zastavena nebo zpomalena, nadbytek ribosomálních proteinů – represorů se začne navazovat na odpovídající mRNA a zastaví translaci (svou i ostatních ribosomálních proteinů).
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
- Řízení genové exprese a proteosyntézy
- Řízení genové exprese a proteosyntézy u eukaryot
- Gen
- Transkripce
- Translace
Zdroje[upravit | editovat zdroj]
- ŠTÍPEK, Stanislav. Stručná biochemie : Uchování a exprese genetické informace. 1. vydání. Medprint, 1998. 92 s. s. 54–62. ISBN 80-902036-2-0.