Biochemická vyšetření jater
Jaterní tkáň
Játra mají nezastupitelnou roli v intermediárním a energetickém metabolismu sacharidů, lipidů a dusíkatých látek, zabezpečují inaktivaci a exkreci endogenních látek a detoxikaci exogenních látek, jsou hlavním místem syntézy plazmatických proteinů a koagulačních faktorů.
Onemocnění jater vyvolává změny četných biochemických parametrů v séru. Laboratorní testy poskytující informaci o různých funkcích jater a jsou důležité pro diagnostiku jaterních chorob. Na základě jejich stanovení lze odhadnout intenzitu poškození jaterního parenchymu.
Pro pochopení interpretace výsledků „jaterních testů” je nezbytná znalost morfologie jaterní tkáně. Asi 72 % tvoří hepatocyty. Kupfferovy buňky, endotel a tukové buňky se podílejí asi 8 % a 1 % buněk tvoří žlučové cesty. Zbytek z celkového objemu jater představuje extracelulární tekutina. Rozsah poškození jednotlivých struktur se liší podle typu onemocnění. Akutní poškození jater (např. virové hepatitidy) je charakterizováno porušením především hepatocytů. U jiných onemocnění může dominovat porucha odtoku žluči spojená s poškozením buněk žlučových kapilár.
Biochemické vyšetření jater
Biochemické testy určené pro vyšetřování jater a žlučových cest můžeme rozdělit do několika skupin:
Ukazatele poškození hepatocytu
V důsledku poškození cytoplazmatické membrány, např. zánětem nebo hypoxií, dochází ke zvýšení její propustnosti a do extracelulárního prostoru se uvolňují enzymy lokalizované v cytoplazmě. Nejcitlivějším indikátorem porušení membrány hepatocytu je zvýšený únik alaninaminotransferázy (ALT) do cirkulace. Dalšími enzymy, které pronikají z hepatocytů do cirkulace, je cytoplazmatický izoenzym aspartátaminotransferázy (cAST) a jaterní izoenzym laktátdehydrogenázy (LD5). Zvýšení aktivity cytoplazmatických enzymů v séru je známkou reverzibilního poškození hepatocytu.
Při závažnějším onemocnění jater doprovázeném rozpadem hepatocytu (nekrózou) se do cirkulace dostávají nejen cytoplazmatické enzymy, ale i enzymy lokalizované v mitochondriích. Diagnostický význam má především glutamátdehydrogenáza (GMD) a mitochondriální izoenzym AST (mAST). Nález zvýšených aktivit mitochondriálních enzymů svědčí pro ireverzibilní, prognosticky závažné postižení jater.
Ukazatele cholestázy
Cholestáza neboli městnání žluči v játrech může vzniknout z mechanických příčin (obstrukce žlučových cest konkrementem nebo tumorem) nebo z poruchy funkce, např. zánětem, působením některých léků nebo na podkladě dědičných poruch. Cholestáza je doprovázena zvýšením aktivity enzymů nacházejících se v membráně endotelu žlučovodů a v kanalikulární membráně hepatocytů a poruchou odtoku bilirubinu do střev. V klinické praxi se běžně vyšetřují enzymy alkalická fosfatáza (ALP) a γ-glutamyltransferáza (GGT), dále bilirubin v krvi a moči a urobilinogen v moči.
Ukazatele biosyntetických funkcí jater
Intenzitu proteosyntetických funkcí jater odráží především stav zrnitého endoplazmatického retikula, kde probíhá tvorba většiny plazmatických bílkovin, ale i syntéza tzv. „exportních proteinů” jako jsou některé enzymy (např. cholinesteráza) a koagulační faktory. Stanovení těchto analytů má význam především u chronických jaterních onemocnění. Na rozdíl od enzymů cytoplazmatických a mitochondriálních, jejichž aktivita se při poškození jater zvyšuje, se pokles proteosyntézy projeví jejich snížením. Pro diagnostické účely se používá především stanovení sérové cholinesterázy, sérového albuminu nebo transferinu a koagulačních faktorů.
Vybraná biochemická vyšetření u jaterních onemocnění
Aminotransferázy
Aminotransferázy jsou enzymy, které katalyzují transaminaci (přenos aminoskupiny z aminokyseliny na ketokyselinu a naopak). V klinické praxi jsou nejdůležitějšími markery alaninaminotransferáza a aspartátaminotransferáza, které odrážejí integritu hepatocytů. Z toho vyplývá, že při poškození jaterního parenchymu dojde ke zvýšení těchto markerů v séru.
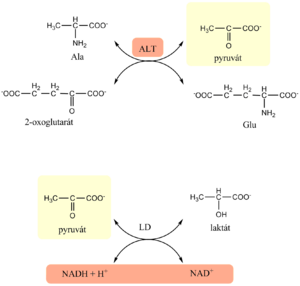
Alaninaminotransferáza (ALT)
Cytoplazmatický enzym, primárně lokalizovaný v játrech, který se uvolňuje při poškození buněčné membrány. Jedná se o vysoce specifický marker pro jaterní onemocnění. Ke zvýšení sérových hodnot dochází již při malém poškození. Dále je obsažen i v kosterních svalech, z čehož vyplývá, že ke zvýšení sérových hodnot dochází i u myopatií.
Fyziologickou funkcí ALT je katalýza transaminační reakce, při níž se reverzibilně přenáší aminoskupina z alaninu na 2-oxoglutarát, za vzniku pyruvátu a glutamátu. Kofaktorem je pyridoxal-5´-fosfát.
| Fyziologické hodnoty S-ALT | |
|---|---|
| Muži | do 0,80 μkat/l |
| Ženy | do 0,60 μkat/l |
Sledování ALT je vhodné pro monitoring průběhu onemocnění.
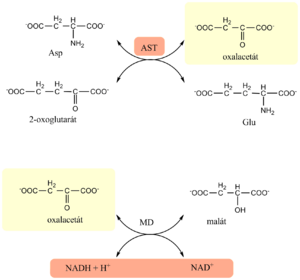
Aspartátaminotransferáza (AST)
Enzym, který se vyskytuje ve dvou formách – cytoplazmatický (AST1, v jaterním parenchymu asi 20 %) a mitochondriální (AST2, v játrech asi 80 %)[1]. Cytoplazmatická frakce se uvolňuje do cirkulace poměrně snadno, i při mírném poškození buněk. Mitochondriální frakce se dostává do krve teprve při nekróze buňky. Vyskytuje se především v játrech, ale také ho najdeme v kosterním svalstvu, myokardu, ledvinách, mozku, pankreatu a erytrocytech.
Jeho fyziologickou funkcí je katalýza reverzibilní transaminace z aspartátu na 2-oxoglutarát. Kofaktorem reakce je pyridoxal-5´-fosfát.
Jedná se o poměrně nespecifický ukazatel. Velmi vysoké hodnoty nacházíme u závažného jaterního poškození (virové hepatitidy, polékové a toxické poškození jater, akutní ischemie, cirkulační šok), při kterém bývají zvýšeny i hodnoty ALT. Dále doprovází poškození kosterního svalstva, infarkt myokardu, po operacích, ale i po dlouhotrvající fyzické námaze.
| Fyziologické hodnoty S-AST | |
|---|---|
| Muži | do 0,85 μkat/l |
| Ženy | do 0,60 μkat/l |
Stanovení hodnot ALT a AST
Pro stanovení koncentrace katalytické aktivity AST a ALT je doporučena metoda založená na principu Warburgova optického testu.
- Stanovení hodnot ALT
- Je založeno na transaminační reakci, která je spřažena s indikační reakcí. Donorem aminoskupiny v transaminační reakci je alanin. Pro indikační reakci používáme enzym laktátdehydrogenázu (LD), která zároveň plní funkci enzymu zabezpečujícího redukci endogenních oxokyselin.
- Postup:
- V první reakci katalyzované ALT vzniká z alaninu pyruvát, který je následně redukován na laktát v indikační reakci katalyzované LD, kterou přidáme do reakční směsi společně s NADH.
- Redukce pyruvátu na laktát je doprovázena úbytkem NADH, který se projeví poklesem absorbance při 334, 340 nebo 365 nm. Katalytická koncentrace ALT je úměrná poklesu absorbance.
- Stanovení hodnot AST
- Je založené podobně jako u ALT na transaminační reakci spřažené s indikační reakcí. Donorem aminoskupiny v transaminační reakci je aspartát, a enzymem pro indikační reakci malátdehydrogenáza (MD).
- Postup:
- V první enzymové reakci, katalyzované AST, se tvoří oxalacetát. Ten je v další indikační reakci redukován malátdehydrogenázou na malát, za současné oxidace NADH na NAD+.
- Na základě úbytku NADH určíme aktivitu AST (úměrná poklesu absorbance při 334, 340 nebo 365 nm).
- V reakční směsi je přítomen pyridoxal-5´-fosfátu, který zabezpečuje dostatečnou saturaci AST a tím i plnou aktivitu enzymu. Přítomnost laktátdehydrogenázy je nezbytná k tomu, aby se zajistila redukce endogenního pyruvátu (zabránění falešně vyšších výsledků).
Klinicko-biochemické využití
Aminotransferázy jsou součástí tzv. jaterních testů, a významně se uplatňují v diagnostice jaterních onemocnění. Hodnoty jaterních transamináz jsou zvýšeny u většiny jaterních onemocnění. Hodnota ALT obvykle převyšuje hodnotu AST.
Nejvyšší hodnoty nacházíme u akutních virových hepatitid, proto které je charakteristické zvýšení koncentrací AST a ALT na několikanásobnou hodnotu. Vzestup o dvoj- až trojnásobek hodnot lze zaznamenat již v prodromálním stádiu onemocnění. Elevace vrcholí 7.–12. den po nástupu ikteru (maximum až 100 μkat/l). K normalizaci hodnot dochází obvykle 5.–8. týden. Výrazně (řádově desetinásobně), ale jen krátkodobě bývají transaminázy zvýšené při těžkých biliárních kolikách. Ostatní jaterní léze jsou zpravidla doprovázeny mírnějším, maximálně pětinásobným vzestupem aktivity a při chronických onemocněních jater bývají aktivity transamináz často jen těsně nad horní hranicí referenčního rozmezí.
Kromě samotných hodnot v séru, je pro nás důležitým ukazatelem i poměr obou enzymů AST/ALT (de Ritisův index). Hodnoty nad 1 bývají prognosticky závažnější. Hodnoty vyšší než 2 jsou specifické pro alkoholové poškození jater.
Obecně lze říct, že míra vzestupu transamináz odráží rozsah jaterního poškození, ale nelze vyvodit informace o etiologii či jaterní funkci. Také je třeba mít na paměti, že při úbytku funkční jaterní tkáně, např. při cirhóze jater, se může množství buněk snížit natolik, že sérové aktivity transamináz spadají do referenčního rozmezí nebo jen těsně nad něj i při rozsáhlé jaterní lézi.
γ-glutamyltransferáza
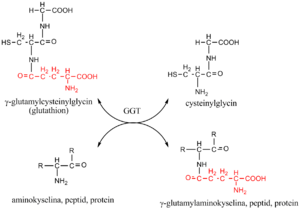
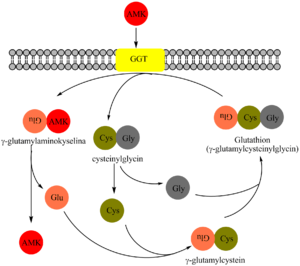
γ-glutamyltransferáza (GGT, dříve též GMT, EC 2.3.2.2) je klíčovým enzymem γ-glutamylového cyklu, který zabezpečuje transport některých aminokyselin a peptidů přes buněčnou membránu z extracelulární tekutiny do buněk.
GGT katalyzuje přenos γ-glutamylové skupiny: z γ-glutamylpeptidů na jiné peptidy, aminokyseliny nebo vodu. Donorem γ-glutamylového zbytku je tripeptid glutathion (γ-glutamylcysteinylglycin) nacházející se v buňkách živočichů, rostlin i bakterií. Chrání organismus před oxidačním stresem (podílí se na odstraňování peroxidu vodíku). Je obnovován reakcí katalyzovanou glutathionreduktázou.
Výskyt GGT
Membrány buněk s vysokou sekreční nebo absorpční kapacitou, játra (mikrozomální frakce hepatocytů a membrány buněk výstelky žlučových cest), proximální tubuly ledvin, enterocyty a pankreas.
Syntézu GGT indukují i některá léčiva (barbituráty, antidepresiva, alkohol). Také se může uvolnit z membrán detergentním působením, např. žlučových kyselin nebo alkoholu.
Hodnocení sérové aktivity GGT
Zvýšení GGT je typické především pro poškození hepatobiliárního traktu. K tomu dochází při intrahepatální nebo extrahepatální cholestáze (v těchto případech je zvýšena i alkalická fosfatáza), hepatocelulárním poškození – akutní a chronická jaterní onemocnění, nádory jater a pankreatu.
Vysoké izolované zvýšení GGT může být známkou poškození jater z důvodů chronického požívání alkoholu. Zvýšená aktivita je u alkoholiků i v případě, že ještě nejsou poškozena játra (indukce syntézy GGT).
Stanovení GGT
Princip stanovení vychází z reakce, kterou GGT katalyzuje fyziologicky v organismu. Sleduje se přenos γ-glutamylového zbytku ze substrátu na akceptor, kterým je glycylglycin. Jako substráty se používají L-γ-glutamyl-p-nitroanilid nebo L-γ-glutamyl-3-karboxy-4-nitroanilid. V průběhu reakce se po přenosu γ-glutamylového zbytku na akceptor uvolňuje barevný p-nitroanilin (ze substrátu L-γ-glutamyl-p-nitroanilidu) nebo 5-amino-2-nitrobenzoát (ze substrátu L-γ-glutamyl-3-karboxy-4-nitroanilidu), jejichž přírůstek je přímo úměrný aktivitě GGT ve vyšetřovaném vzorku.
| Fyziologické hodnoty fS-GGT | |
|---|---|
| Muži | 0,14–0,84 μkat/l |
| Ženy | 0,14–0,68 μkat/l |
Fyziologicky jsou vyšší hodnoty GGT u mužů, vzhledem k vyššímu obsahu v prostatě.
[zdroj?]
Karbohydrátdeficientní transferin
Za nejlepší biochemický marker jedné z nejčastějších příčin poškození jater, abusu alkoholu, byla do nedávna považována γ-glutamyltransferáza (GGT). V současné době přibývá další parametr, karbohydrát deficientní transferin (CDT).
Transferin obsahuje jako glykoprotein ve své molekule obvykle čtyři až šest zbytků kyseliny sialové. Při chronickém abusu alkoholu (60 g alkoholu za den po dobu alespoň dvou až tří týdnů) se zvyšuje podíl transferinu, v jehož struktuře kyselina sialová chybí (0-2 sialové kyseliny na molekulu) – tzv. karbohydrát deficientní transferin (CDT). Za známku chronického abusu alkoholu se považuje, překročí-li podíl CDT 6 % z celkového transferinu. Hladina CDT zůstává zvýšena ještě asi 2 týdny od začátku abstinence.
- ↑ SEPULVEDA, Jorge L.. Challenges in routine clinical chemistry analysis. In Amitava Dasgupta, Jorge L. Sepulvedatitul. Accurate Results in the Clinical Laboratory. 2. vydání. Elsevier, 2019. s. 141-163. ISBN 9780128137765