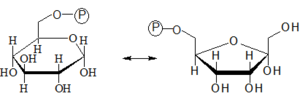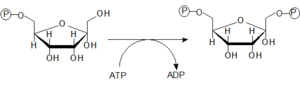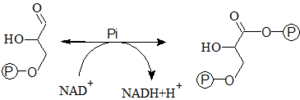Embden-Meyerhof-Parnasova dráha
Glykolýza (neboli Embden-Meyerhof-Parnasova dráha) je základní metabolický děj probíhající v cytoplazmě všech buněk lidského těla. Řadí se mezi katabolické dráhy. Glykolýzou vznikají z jedné molekuly glukózy dvě tříuhlíkaté molekuly – pyruvát (Pyr) či laktát (Lac). Glykolýza plní mnoho funkcí, například zisk energie či tvorbu acetyl-CoA jako substrátu pro syntézu lipidů.
Glykolýza probíhá jak za aerobních, tak i za anaerobních podmínek. Za aerobních podmínek se vytvářejí dvě molekuly pyruvátu, dvě molekuly ATP a dvě molekuly NADH. Za anaerobních podmínek podléhá pyruvát další reakci, která regeneruje kofaktor NAD+ – produktem je pak laktát.
Reakce glykolýzy[upravit | editovat zdroj]
Celou glykolýzu můžeme souhrnně zapsat jako rovnici:
- Glukóza + 2 NAD+ + 2 ADP + 2 Pi → 2 pyruvát + 2 NADH + 2 ATP + 2 H2O
Glykolýza se dělí do několika fází:
- Investice energie a současná aktivace molekul glukózy.
- Štěpení hexózy na dvě triózy.
- Oxidace trióz a současný zisk energie.
- Přeměna pyruvátu na laktát (za anaerobních podmínek).
- V následujícím přehledu popíšeme její jednotlivé reakce
- 1. Fosforylace glukózy
- Po vstupu molekul glukózy do buněk dochází k jejich okamžité fosforylaci. Tato reakce přeměňuje neutrální molekulu glukózy na anion. Takto modifikovaná glukóza může být dále metabolizována a současně již neprochází buněčnou membránou. Zachycuje se tedy v cytosolu, kde je dále metabolizována.
- Glukóza + ATP → Glc-6-P + ADP
- Kromě jedné makroergní vazby molekuly ATP vyžaduje reakce i enzymovou katalýzu zprostředkovanou jedním ze dvou izoenzymů – hexokinázou či glukokinázou.
- Glukokináza (neboli hexokináza typu IV) je lokalizována pouze v hepatocytech a v β-buňkách pankreatu, zatímco hexokináza je ve všech tkáních. Kromě lokalizace se liší i ve svých fyzikálně-chemických vlastnostech. Glukokináza má vysokou hodnotu KM (10 mmol/l), a proto je aktivována až při vyšších koncentracích glukózy. Uplatňuje se převážně po jídle, kdy je koncentrace glukózy v portální krvi vysoká a je zapotřebí ji vychytávat játry (např. pro syntézu glykogenu). β-buňky pankreatu zároveň reagují na vyšší hladiny glykémie zvýšením sekrece inzulinu.
- Hexokináza je za fyziologických podmínek vždy téměř plně aktivní, neboť její KM je pouhých 0,1 mmol/l (srovnej s fyziologickým rozsahem glykémie 3,3–5,6 mmol/l). Její aktivita je tedy regulována jiným mechanismem a tím je inhibice svým vlastním produktem – Glc-6-P. Zjednodušeně se tedy dá říci, že hexokináza produkuje tolik Glc-6-P, kolik je buňka schopna utilizovat ve svých drahách. Jakmile se začne Glc-6-P hromadit, dojde k inhibici hexokinázy. Kromě fosforylace glukózy umožňuje hexokináza i fosforylaci fruktózy.
- 2. Izomerizace Glc-6-P na Fru-6-P
- Izomerizace Glc-6-P na Fru-6-P je reverzibilní reakce probíhající za katalýzy hexosafosfátizomerázou.
- 3. Fosforylace Fru-6-P za spotřeby ATP na Fru-1,6-bisP
- Fosforylaci Fru-6-P na Fru-1,6-bisP katalyzuje enzym 6-fosfofrukto-1-kináza. Jedná se o klíčový allosterický regulační enzym glykolýzy.
- V průběhu dosavadních tří kroků došlo k investici dvou molekul ATP na jednu molekulu glukózy.
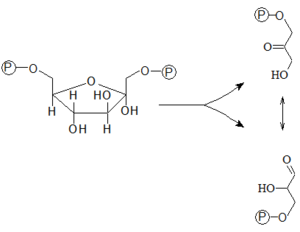
- 4. Aldolové štěpení Fru-1,6-bisP na dvě fosforylované triózy
- Fru-1,6-bisP se následně štěpí na dvě fosforylované triózy – glyceraldehyd-3-P (Gra-3-P, aldóza) a dihydroxyaceton-3-P (DHA-3-P, ketóza). Katalýzu zajišťuje aldoláza spadající do třídy lyáz. Rozlišujeme její dva izoenzymy – aldolázu A a B.
- 5. Izomerace trióz
- Glyceraldehyd-3-P a dihydroxyaceton-3-P se mohou přeměnit jeden v druhý pomocí enzymu triózafosfátizomerázy. Této reakci se přikládá velký význam, protože do další reakce glykolýzy se zapojuje jen glyceraldehyd-3-P a tato izomerace kontinuálně doplňuje jeho cytosolický pool.
- 6. Oxidace glyceraldehyd-3-P na 1,3-bisfosfoglycerát
- Tato reakce je jedinou oxidační reakcí v celé glykolýze. Oxidaci katalyzuje glyceraldehyd-3-fosfátdehydrogenáza. Reakcí vzniká 1,3-bisfosfoglycerát (energeticky bohatá sloučenina) a redukovaný kofaktor – NADH+H+. Reakce je exergonní – na oxidací nově vzniklou skupinu COO– se naváže Pi makroergní anhydridovou vazbou.
- 7. Přeměna 1,3-bisfosfoglycerátu na 3-fosfoglycerát
- 1,3-bisfosfoglycerát je hydrolyzován na 3-fosfoglycerát pomocí fosfoglycerátkinázy. Zároveň dojde k substrátové fosforylaci (fosforylace na substrátové úrovni) – z ADP se tvoří ATP.
- 8. Izomerace 3-fosfoglycerátu na 2-fosfoglycerát
- Izomeraci katalyzuje fosfoglycerátmutáza.
- 9. Dehydratace 2-fosfoglycerátu na fosfoenolpyruvát (PEP)
- Dehydrataci 2-fosfoglycerátu katalyzuje enzym enoláza. Reakce vede ke vzniku makroergní sloučeniny fosfoenolpyruvátu, který obsahuje esterově vázanou fosfátovou skupinu.
- 10. Přeměna fosfoenolpyruvátu na pyruvát
- Nejdříve probíhá odštěpení Pi, poté se nestabilní enol-pyruvát izomerizuje na stabilnější keto-pyruvát. Během této přeměny se uvolňuje velké množství volné energie. Tato reakce je tedy silně exergonická a prakticky nevratná. Uvolněná energie se využije k syntéze ATP z ADP – substrátová fosforylace.
- Reakci katalyzuje regulační enzym pyruvátkináza.
Během 4.–10. reakce se vytvořily dvě molekuly ATP na jeden tříuhlíkatý fragment (Pyr). Energetická bilance celé glykolýzy je tedy +2 moly ATP na 1 mol glukózy (−2 ATP spotřebováno, +4 ATP vytvořeno).
Metabolické osudy pyruvátu[upravit | editovat zdroj]
Pyruvát je větvícím bodem glykolýzy. Osud pyruvátu závisí na oxidačním stavu buňky – NADH musí být reoxidováno na NAD+.
Za aerobních podmínek se pyruvát transportuje do matrix mitochondrie, kde se prostřednictvím pyruvátdehydrogenázové reakce mění na acetyl-CoA, který se může zapojit například do Krebsova cyklu. Redukovaný kofaktor NADH nemůže jednoduše přestoupit do matrix mitochondrie, kde by se měl zapojit do procesů v dýchacím řetězci, protože mitochondriální membrána je pro něj nepropustná. Proto se využívá k redukci některých látek – např. cytoplazmatického oxalacetátu na malát či dihydroxyaceton-P na glycerol-3-P. Vzniklé produkty již vnitřní mitochondriální membránou procházejí a dopraví tak redukční ekvivalenty do mitochondrie. Hovoříme o tzv. člunkovém mechanismu či jednoduše o čluncích. Pro přestup NADH existují v buňce dva různé člunky (anglicky shuttle) – glycerol-fosfátový a malát-aspartátový. V mitochondrii proběhnou výše uvedené reakce opačným směrem:
- Malát + NAD+ → oxalacetát + NADH+H+
- Glycerol-3-P + FAD → dihydroxyaceton-P + FADH2
Získané redukované kofaktory následně mohou vstoupit do mitochondriálního dýchacího řetězce, kde jsou regenerovány – souběžně vzniká aerobní fosforylací ATP. Návrat oxalacetátu (OAA) zpět do cytosolu není přímý. Vyžaduje nejdříve transaminaci na aspartát, kterou katalyzuje aspartátaminotransferáza (AST). V cytosolu proběhne opačná reakce – vzniká OAA.
Za anaerobních podmínek (např. intenzivně pracující sval s nedostatečnou dodávkou kyslíku) či v erytrocytech se pyruvát přeměňuje na laktát, který je následně uvolněn z buňky do krevního oběhu. Zároveň dochází k regeneraci NAD+. Reakci katalyzuje enzym laktátdehydrogenáza (LDH):
- Pyruvát + NADH + H+ → laktát + NAD+
Touto reakcí vytvořené NAD+ je koenzymem pro glyceraldehyd-3-fosfátdehydrogenázu, bez níž by se glykolýza zastavila. Vznikající laktát se jednak může zapojit do Coriho cyklu, jednak může být oxidován v tkáních s aerobním metabolismem (srdce, játra) na CO2 a H2O. Kumulace laktátu podmiňuje pokles pH, který způsobí svalovou bolest a únavu.
Na tomto místě je třeba připomenout, že aerobní glykolýza produkuje mnohem více ATP na 1 mol glukózy než anaerobní glykolýza.
2,3-BPG shunt[upravit | editovat zdroj]
V erytrocytech hraje významnou roli odbočka glykolýzy nazývaná 2,3-BPG shunt. 1,3-bisfosfoglycerát se při ní přeměňuje na 2,3-bisfosfoglycerát. Tento meziprodukt již neobsahuje makroergicky vázaný fosfát, a při jeho další přeměně na 3-fosfoglycerát se tedy nesyntetizuje ATP – uvolní se jen anorganický fosfát. Erytrocyt tak při tomto průběhu glykolýzy získá méně ATP. Význam odbočky ale spočívá v tom, že 2,3-bisfosfoglycerát snižuje afinitu hemoglobinu ke kyslíku, tj. podílí se na regulaci transportu kyslíku na hemoglobinu.
Regulace glykolýzy[upravit | editovat zdroj]
Regulačními body v glykolýze jsou tři enzymy:
- 6-fosfofrukto-1-kináza;
- pyruvátkináza;
- hexokináza.
- Tyto enzymy katalyzují nevratné exergonní reakce.
6-fosfofrukto-1-kináza (PFK-1)[upravit | editovat zdroj]
Fosfofruktokináza, allosterický enzym regulovaný několika aktivátory a inhibitory, je hlavním regulačním bodem glykolýzy:
- Zvýšení poměru ATP / AMP vede k inhibici glykolýzy
- Glykolýza je děj směřující ke tvorbě ATP.
- ATP je substrátem a současně i allosterickým inhibitorem tohoto enzymu. AMP se oproti tomu chová jako aktivátor enzymu. Při nadbytku ATP se tedy zastaví další spotřeba glukózy jako živiny.
- Citrát inhibuje glykolýzu
- Pokud jsou oxidovány mastné kyseliny, vzniklý acetyl-CoA inhibuje PDH.
- Vznikající pyruvát směřuje do karboxylace na oxalacetát. Je-li současně dostatek acetyl-CoA i oxalacetátu, syntetizuje se citrát, který se hromadí před enzymem isocitrátdehydrogenázou. Citrát uniká do cytoplazmy, kde blokuje regulační enzym glykolýzy. Signalizuje totiž, že v mitochondrii je dostatek substrátů Krebsova cyklu, a tudíž není zapotřebí tvořit další.
- Fruktóza-2,6-bisfosfát (Fru-2,6-P)
- Fruktóza-2,6-bisfosfát, aktivátor glykolýzy, funguje jako prodloužená ruka inzulinu – jeho koncentrace se zvyšuje, pokud je poměr inzulin / glukagon zvýšený. Vzniká z fruktóza-6-P reakcí katalyzovanou 6-fosfofruktokinázou-2 (PFK-2).
- Glykolýzu aktivuje inzulin a inhibují ji kontraregulační hormony
- Vzestup poměru inzulin / glukagon snižuje intracelulární koncentraci cAMP; tím nastává převaha defosforylačních dějů. Pokles poměru a působení dalších kontraregulačních hormonů vyvolá naopak vzestup koncentrace cAMP – převažují fosforylační děje. 6-fosfofrukto-1-kináza je aktivní v defosforylované formě.
- Inhibice kyselým pH
- 6-fosfofrukto-1-kináza je inhibována protony. Jak pyruvát, tak laktát jsou poměrně silné kyseliny a jejich významná akumulace by mohla ohrozit buňku. Proto jejich zvýšené koncentrace vedou skrze protony k inhibici regulačního enzymu.
Zbylé enzymy mají menší význam, proto je popíšeme jen velmi stručně. Jak jsme již uvedli, hexokinázu jednak inhibuje její produkt – Glc-6-P, jednak ji aktivuje inzulin. Pyruvátkinázu reguluje kovalentní modifikace pod vlivem poměru inzulin / glukagon.
Klinické korelace[upravit | editovat zdroj]
Mezi poměrně časté enzymatické defekty patří vrozený deficit pyruvátkinázy. Postiženy jsou převážně erytrocyty, v nichž se tvoří méně ATP. Z toho vyplývá jejich nižší schopnost udržet integritu své membrány (aktivní membránové transporty) a svůj tvar. Důsledkem je jejich zvýšený rozpad – rozvíjí se hemolytická anémie. Při nedostatečném okysličování tkání (hypoxii) se ve zvýšené míře tvoří laktát, který jako poměrně silná kyselina způsobuje okyselení těla – tomuto poklesu pH se říká laktátová acidóza.