Sarkoidóza (interna)
(přesměrováno z Sarkoidosa)
| Sarkoidóza | |
| Sarcoidosis | |
| Sarcoidosis | |
 Typické příznaky sarkoidózy | |
| Diagnostika | laboratoř, RTG, biopsie, CT, NMR, PET, Ga-scintigafie, Tl-scintigrafie, Tc-scintigrafie, Bronchoalveolární laváž |
|---|---|
| Léčba | Glukokortikoidy, Cytostatika, Antimalarika, Anti TNF |
| Mortalita ve světě | 1–5 % |
| Klasifikace a odkazy | |
| MKN | D86 |
| MeSH ID | D012507 |
| OMIM | 181000 |
| MedlinePlus | 000076 |
| Medscape | 301914 |
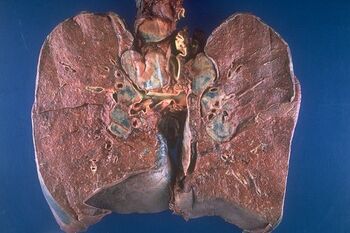
Sarkoidóza je multisystémové granulomatózní onemocnění z neznámé příčiny. Nejčastěji postihuje lidi mladé a ve středním věku. Často se manifestuje bilaterální hilovou lymfadenopatií (BHL), plicními infiltráty a očními a kožními lézemi. Játra, slezina, lymfatické uzliny, slinné žlázy, srdce, nervový systém, svaly, kosti a další orgány mohou být také postiženy. Diagnóza je stanovena, pokud jsou radiologické nálezy podpořeny histologickým průkazem nekaseifikujících granulomů z epiteloidních buněk. Musí být vyloučeny granulomy ze známých příčin a lokální sarkoidní reakce.[1]
Etiologie[upravit | editovat zdroj]
Etiologie je neznámá. Zvažovány jsou genetické faktory, infekční agens, imunopatologické procesy. Zřejmě neexistuje žádné konkrétní agens ani jediný diskrétní imunologický defekt způsobující sarkoidózu.
Granulomatózní reakce představuje „imunologickou záložní pozici“ u osob, které nejsou schopny odstranit imunologická agens efektivnějším způsobem. Vznik sarkoidózy je tak vysvětlován specifickou interakcí mezi jednou či několika expozicemi a jedním či několika druhy imunitní odpovědi.
- Možné spouštěče
- Bakterie: Mycobacterium tuberculosis, atypická mykobakteria, Propionibactertium acnes, Rickettsia, Borrelia, Mycoplasma.
- Viry: EBV.
- Anorganické látky: hliník, zirkonium, minerální vlákna, křemík, jíl, talek.
- Organické látky: borovicový pyl, škrob.
Epidemiologie[upravit | editovat zdroj]
Incidence je 21,6/100 000 u žen a 15,3/100 000 u mužů. Vrchol je mezi 35 a 45 lety.[2] Je zde patrná výrazná etnická a rasová heterogenita prezentace – u černochů těžší průběh a častější uveitida, vyšší výskyt lupus pernio u Portoričanů, u kavkazské rasy je častější asymptomatické onemocnění, u Japonců je zase častější oční a srdeční postižení. Výskyt erythema nodosum v závislosti na rase se v různých studiích liší. Mortalita onemocnění je 1–5 %. Kuřáci jsou postiženi méně často (21,9 %).
Některé epidemiologické studie poukazují na sezónní výskyt, jiné na možnost interpersonálního přenosu a profesionální expozice.
V genetických studiích bylo zjištěno sdružení s I HLA-A 188 a II HLA-DR3 u bělochů; HLA-DQB1 0201, HLA-DRB1 0301 u Löfgrenova syndromu; HLA-DQB1 1501, HLA-DQB1 0602 u pacientů s chronickou sardkoidózou a až pětinásobně vyšší výskyt sarkoidózy u jedinců s nemocným rodičem nebo sourozencem.
Patogeneze[upravit | editovat zdroj]
Makrofágy zřejmě vlivem interakce antigenu s IFN-gamma mají zvýšenou expresi molekul HLA II a prezentují předpokládaný antigen CD4 buňkám Th1 typu a prostřednictvím produkce IL 12 způsobují další akumulaci CD4 buněk a jejich diferenciaci do Th1 typu s následnou produkcí IFN-gamma. Tyto aktivované T-buňky uvolňují IL-2 a chemotaktické faktory způsobující hromadění monocytů a makrofágů v místě aktivity onemocnění a expanzi rozličných klonů T-buněk. IFN-gamma dále aktivuje makrofágy a transformuje je v epitheloidní a mnohojaderné obrovské buňky, které tvoří základ granulomu a produkují ACE. Makrofágy produkuji TNF-alfa, jež je klíčovým cytokinem pro integritu granulomu. Lymfocyty CD4, CD8 a menší množství B-lymfocytů pak formují lem v okolí granulomu.
Již v časném stádiu tvorby granulomu se u některých jedinců zřejmě vlivem zvýšené produkce makrofágových fibrogenních cytokinů (TGF-beta, PDGF, IGF-I) nebo proto, že antigen je prezentován odlišnou třídou HLA dochází k posunu produkce cytokinů do fenotypu Th2 (IL-4, IL-6, IL-B, IL-15,). Tato odpověď nevede k eliminaci patogenu a ústí v kontinuální formaci granulomu s chronickým onemocněním. Z nejasných důvodů se v některých případech začíná tento shluk buněk obalovat denzním pruhem fibroblastů, mastocytů. kolagenních vláken a proteoglykanů. Tato fibrotická odpověď může působit podstatnou, často irreverzibilní orgánovou destrukci a fyziologickou dysfunkci.
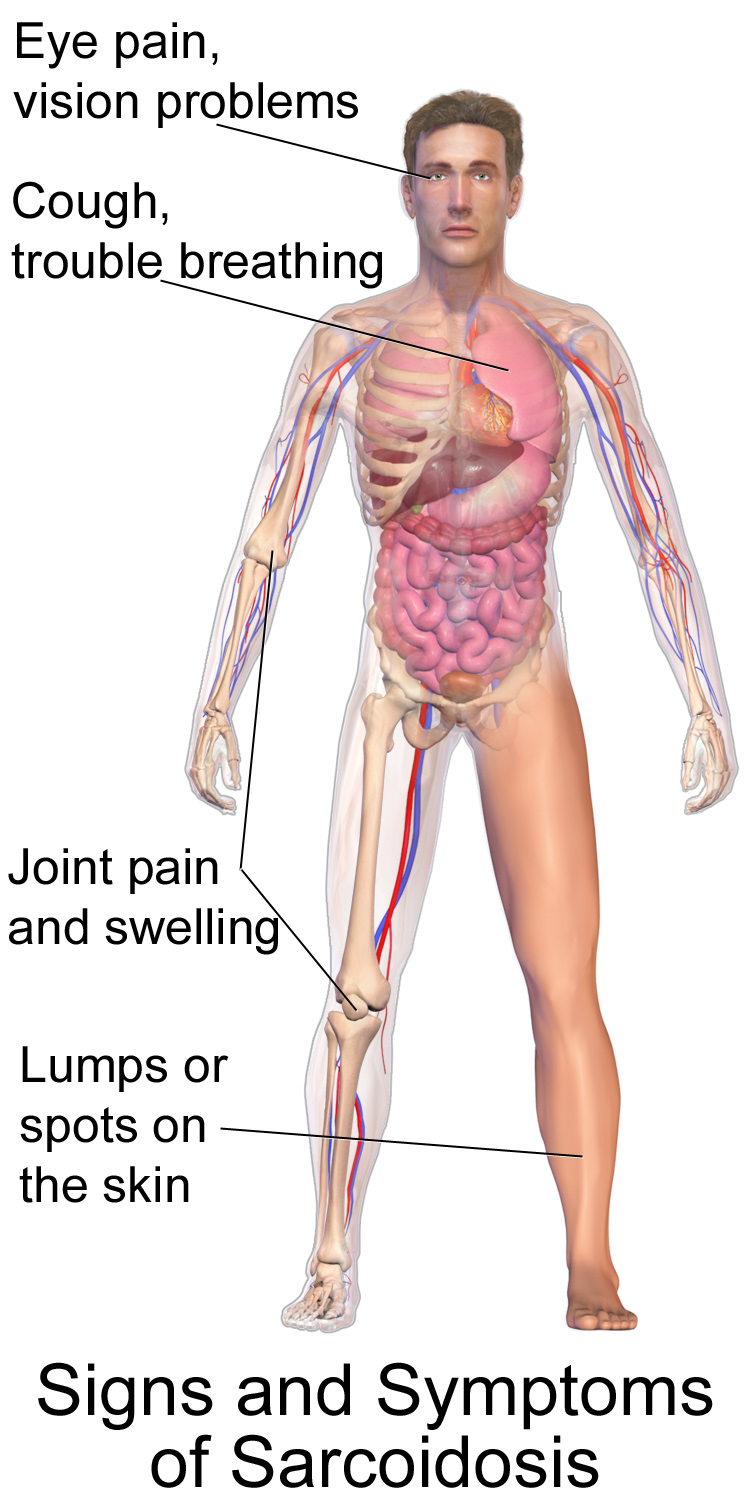
Celkové příznaky[upravit | editovat zdroj]
Mezi celkové příznaky řadíme horečku (většinou subfebrilie), vyčerpání, únavu, ztrátu hmotnosti (2–6 kg v průběhu 10–12 týdnů před manifestací), někdy také noční pocení. Celkové příznaky jsou obecně více vyjádřené u černochů a původních Američanů.
Plicní postižení[upravit | editovat zdroj]
Plicní postižení se vyskytuje u více než 90 % pacientů. Manifestuje se dušností, suchým kašlem, bolestí na hrudi. Bolest se projevuje spíše jen tlaky na hrudi, může ale i imitovat anginózní bolest. Chrůpky a hemoptýza jsou vzácná; hemoptýza však může mít fatální průběh. Bilaterální hilová lymfadenopatie se vyskytuje asi u 3/4 pacientů.
Možný je také nález bronchiální hyperreaktivity, endobronchiálních granulomů, abnormálního funkčního vyšetření plic, pleurálního výpotku, pneumothoraxu, zesílení či kalcifikací pleury, popřípadě kavitací.
|
| |||||||||||||||||||||||||||
Mimoplicní sarkoidóza[upravit | editovat zdroj]
Mimo plíce mohou být sarkoidózou postiženy oči, nervy, lymfatický systém, srdce, játra, pohybový aparát, endokrinní systém, ledviny, gastrointestinální trakt, příušní žlázy či reprodukční orgány. Dále může být sarkoidóza příčinou poruch metabolismu (hyperkalcémie, hyperkalciurie) i hematologických abnormalit (anémie, leukopenie, lymfopenie).
Až 20 % pacientů se sarkoidózou má přidružené autoimunitní onemocnění – hypothyreóza, Gravesova choroba, CVID (Common Variable ImmunoDeficiency).
Diagnostika[upravit | editovat zdroj]
![]() Definitivní diagnóza může být stanovena jedině průkazem nekaseifikujících granulomů v postiženém orgánu, identifikací typického klinického nálezu a vyloučením všech ostatních diagnostických možností.
Definitivní diagnóza může být stanovena jedině průkazem nekaseifikujících granulomů v postiženém orgánu, identifikací typického klinického nálezu a vyloučením všech ostatních diagnostických možností.
Jedině pacienti s Löfgrenovým syndromem nevyžadují biopsii, pokud ústup onemocnění je rychlý a spontánní.
Laboratoř[upravit | editovat zdroj]
Nespecifickým laboratorním vyšetřením je elevace sérového angiotenzin-konvertujícího enzymu (S-ACE). Jeho zvýšení pod dvojnásobek horního limitu normy není nikdy diagnostické. Při zvýšení nad dvojnásobek je diagnóza sarkoidózy pravděpodobná. Je však nutné vyloučit jiná granulomatózní onemocnění (TBC, Gaucherovu chorobu) a hyperthyreoidismus.
RTG[upravit | editovat zdroj]
Nejcharakterističtějším nálezem je BHL (vyskytuje se u 50–80 % pacientů se sarkoidózou; pacienti se sarkoidózou tvoří 74 % všech pacientů s BHL). BHL může být dále znakem malignity (lymfom, bronchogenní karcinom, mimohrudní nádory).
U 25–50 % pacientů nalézáme infiltrativní změny, které jsou většinou oboustranné, symetrické, s predilekcí pro centrální oblasti a horní laloky zejména posteriorní a apikální segmenty v podobě retikulárních, retikulonodulárních nebo fokálních alveolárních opacit. Difuzní miliární postižení či difuzní obraz mléčného skla jsou ojedinělým nálezem.
Později může destrukce plicního parenchymu vést k architektonické distorzi, retrakci hilu, ztrátě objemu horních laloků, širokým a hrubým septálním pruhům, voštinovitým a bulózním změnám. U pokročilých stádií III a IV mohou být přítomny rozšířené pulmonální arterie a bronchiektazie. Pleurální výpotek či kavitace pozorovatelné na prostém skiagramu jsou u pacientů se sarkoidózou vzácností.
Biopsie[upravit | editovat zdroj]
Biopsie a následné histopatologické a imunohistochemické vyšetření.
CT[upravit | editovat zdroj]
- Reverzibilní změny: nitrohrudní lymfadenopatie (hilová, mediastinální, paraaortální, subkarinání) s predilekcí v horních a středních oblastech plic s perihilózní distribucí.
- Léze uložené v podél bronchovaskulárních svazků a lymfatických cév.
- Noduly (mikroskopické, makroskopické, většinou 1–2 mm v průměru s neostrým ohraničením).
- Konsolidace (léze napodobující masy, splývavé alveolární opacity), opacity mléčného skla, zesílení bronchovaskulárních svazků a interlobulárních sept, neseptální linie, subpleurální lineární opacity.
Chronické změny: bronchiektázie, bronchioloektázie, cysty, buly, paracikatriální emfyzém, anatomická distorze, ztráta objemu (zvláště v horních lalocích a retrakcích hilů), mycetomy v preexistujicích kavitách, kalcifikované uzliny. Pokud je přítomná voštinovitá plíce, bývá v horních lalocích nebo perihilózně.
NMR[upravit | editovat zdroj]
V případě plicní sarkoidózy má nižší rozlišovací schopnost než CT vyšetření, proto v této oblasti má své místo pouze u pacientů s kontraindikovaným podáním jodové kontrastní látky. Gadolinem obohacené NMR je však suverénní metodou v diagnostice a sledování neurosarkoidózy. U srdeční sarkoidózy je senzitivita NMR 75–100 %, nelze ji však použít u pacientů s kardiostimulátorem.
PET[upravit | editovat zdroj]
Nedokáže odlišit sarkoidózu a lymfom. Používá se pro diagnostiku a sledování srdeční sarkoidózy, kde má senzitivitu až 100 %, avšak při nízké specificitě (35 %).
Ga-scintigrafie[upravit | editovat zdroj]
Obraz pandy v obličejové části (slzné žlázy a příušní žlázy) a lambdy v celotělovém zobrazení (bilaterální hilové a paratracheální uzliny) pouze podporuje diagnózu sarkoidózy, případně je indikací k invazivnějšímu vyšetření. Tento klasický obraz je přítomný jen u malého množství pacientů. Samotný obraz lambdy je vysoce nespecifický a byl pozorován i u pacientů s lymfomem. Negativní vyšetření navíc nevylučuje přítomnost granulomů v jakémkoli orgánu.
Ga-scintigrafie není užitečná k predikci prognózy a indikaci léčby s výjimkou srdeční sarkoidózy, kde v kombinaci s Tl-scintigrafií umožňuje predikovat odpověď na kortikosteroidy.
V současné době se indikace Ga-scintigrafie omezují na pacienty s normálním či nejednoznačným RTG nálezem hrudníku a klinickým obrazem mimohrudní sarkoidózy, dále k určení místa mimohrudní biopsi u klinicky němých onemocnění, k rozlišení aktivního plicního onemocnění jako známky relapsu u pacientů s fibrotickými změnami a k určení aktivity před orgánovou transplantací.
Tl-scintigrafie, Tc-scintigrafie[upravit | editovat zdroj]
Tl-scintigrafie je užitečná pro diagnostiku srdečního postižení, vyšší senzitivitu má vyšetření myokardu Tc-scintigrafií.
Bronchoalveolární laváž[upravit | editovat zdroj]
Lymfocytóza se zvýšeným imunoregulačním indexem (IRI) CD4/CD8 nad 3,5 má pro sarkoidózu, pokud zvažujeme diferenciální diagnostiku plicních onemocnění obecně, specifitu 50 %, která vzrůstá až na 94 %, pokud bereme v potaz pouze intersticiální plicní choroby. Senzitivita BAL je 53 %.
Zvýšení IRI se vyskytuje taktéž u beryliózy, azbestózy, TBC, morbus Crohn, RA, které lze vyloučit na základě jiných faktorů. Nízká hodnota nevylučuje diagnózu sarkoidózy, protože normální hodnoty se vyskytují u 30 % pacientů, snížené hodnoty u 10 % pacientů v době diagnózy.
Kveimův test[upravit | editovat zdroj]
V současnosti je provádění Kveimova testu považováno za neetické. Neprovádí se.
U pacientů se sarkoidózou se v místě aplikace vytvoří drobné tmavočervené uzlíky, biopsie a následné histopatologické vyšetření z tohoto místa prokáže přítomnost sarkoidních granulomů.[4]
Eventuálně je indikovaný v případě normálního nálezu na RTG a CT, v případě uveitidy nejasného původu, hyperkalciurie, jaterního granulomatózního postižení, suspektní neurosarkoidózy nebo rekurentního erythema nodosum. Je však obtížně dostupný, nesnadno proveditelný, jsou nutné zkušenosti s jeho interpretací a existuje nebezpečí přenosu infekčního agens včetně prionů (bovinní spongiformní encefalopatie[5]).
Test byl pojmenován po norském patologovi Mortenu Ansgaru Kveimovi.[6]
Histologická diferenciální diagnostika[upravit | editovat zdroj]
- TBC, atypická mykobakterióza, brucelóza, toxoplazmóza, granulomatózní histiocytární nekrotizující lymfadenitida, nemoc z kočičího škrábnutí.
- Sarkoidní reakce při karcinomu, morbus Hodgkin, nonhodgkinský lymfom.
- GLUS syndrom (granulomatous lesions of unknown significance).
Prognóza[upravit | editovat zdroj]
Horší prognóza je u černochů, při vzniku u pacientů nad 40 let, u trvání symptomů déle než 6 měsíců, při absenci erythema nodosum, při splenomegalii, při postižení více než 3 orgánových systémů a u III. stádia plicního postižení.
Pokud nedojde ke spontánní remisi do dvou let, pravděpodobnost přechodu do chronické či perzistentní formy je vysoká.
Mortalita je 1–5 %. Příčinou úmrtí bývá respirační insuficience, postižení CNS nebo postižení myokardu.
Sledování[upravit | editovat zdroj]
Nejintenzivnější sledování by mělo být v prvních dvou letech onemocnění. Monitoring by měl pokračovat minimálně 3 roky od skončení léčby.
- Ve stádiu I – každých 6 měsíců.
- Ve stádiu II, III a IV – každých 3–6 měsíců.
Sledujeme kliniku a funkční testy. RTG provádíme jen v případě jejich zhoršení, při vývoji kardiomegalie nebo nově ve stádiu IV. Stanovujeme aktivitu onemocnění – počet lymfocytů v BAL, S-ACE. Ga-scintigrafie příp. CT vyšetření mohou určit aktivní onemocnění, avšak nepredikují prognózu, odpověď na léčbu, přítomnost a intenzitu zánětu – není jasné, zda takto prokázané aktivní onemocnění vyžaduje léčbu.
Léčba[upravit | editovat zdroj]
- Glukokortikoidy (nežádoucí účinky: zvýšená chuť k jídlu, diabetes, osteoporóza, vředová choroba gastroduodenální).
- Cytostatika: metotrexát (hepatotoxicita, pneumotoxicita), azathioprin (myelotoxicita, karcinogenita), cyklofosfamid (myelotoxicita, výrazná karcinogenita).
- Antimalarika: chlorochin, hydrochlorochin (oční toxicita).
- Anti TNF: infliximab /Remicade®/ (riziko infekce včetně TBC, karcinogenita – lymfom), thalidomid (zácpa, bolesti břicha, vyrážka, spavost, periferní neuropatie).
Léčba plicní sarkoidózy[upravit | editovat zdroj]
Vzhledem k tomu, že by nebylo etické asymptomatické pacienty vystavit vedlejším účinkům dlouhodobé systémové kortikoterapie a symptomatické pacienty se závažnám funkčním postižením ponechat bez léčby, jsou možnosti provedení kontrolovaných studií omezené. V současnosti neexistují přesvědčivé důkazy zlepšení plicních funkcí při systémové kortikoterapii ani jejího efektu na dlouhodobou progresi onemocnění a jsou jen omezené důkazy účinnosti imunosupresivní a cytostatické léčby.
Názory na to, kdy zahájit léčbu kortikosteroidy se různí, podle většiny autorů by vzhledem k nízké mortalitě a potenciálním závažným vedlejším účinkům systémových kortikosteroidů měla být léčba vyhrazena pro pacienty symptomatické či pacienty s rychle progredujícímu RTG změnami.
U léky navozené remise je četnost relapsu až 76 % vs. 2–8 % u spontánních remisí.
Chronická plicní sarkoidóza je definována perzistentními symptomy trvajícími déle než 2 roky, avšak ne všichni tito pacienti mají aktivní zánět. Chronické symptomy u sarkoidózy mohou být i důsledkem fibrózy nebo faktorů, které nemají souvislost se sarkoidózou (např. dušnost při nadváze po kortikoidní léčbě). ![]() Vzhledem k nedostatku důkazů ospravedlňujících zahájení léčby závažností rentgenových změn nebo poruchy plicních funkcí, měla by být léčba vyhrazena pro nemocné s recentním zhoršením plicních funkcí nebo kritickým orgánovým postižením. Role kortikosteroidů v léčbě chronické plicní sarkoidózy zůstává kontroverzní.
Vzhledem k nedostatku důkazů ospravedlňujících zahájení léčby závažností rentgenových změn nebo poruchy plicních funkcí, měla by být léčba vyhrazena pro nemocné s recentním zhoršením plicních funkcí nebo kritickým orgánovým postižením. Role kortikosteroidů v léčbě chronické plicní sarkoidózy zůstává kontroverzní.
Vzhledem ke komplexnímu účinku kortikosteroidů na zánětlivé procesy u sarkoidózy a tomu, že u více než 25 % pacientů je možno kortikosteroidy zcela vysadit a jen 20 % pacientů potřebuje více než 10 mg prednisonu denně, doporučují někteří autoři chronické podávání 5–10 mg prednisonu denně v monoterapii.
Jiní autoři argumentují minimálním zlepšením plicních funkcí a RTG změn při více než 50% výskytu vedlejších účinků při léčbě kortikosteroidy a preferují použití metotrexátu (10 mg/týden), azathioprinu (200 mg/den) či infliximabu (3 mg/kg à 2 týdny) jako steroidy šetřícího či zcela nahrazujícího léku. Nicméně u infliximabu byl v případě plicní sarkoidózy prokázán pouze statický nikoliv biologický efekt (Baughman). Efekt etanerceptu nebyl prokázán[7], proto tato léčba není rutinně doporučována. V případě nedostatečné kontroly sarkoidózy kortikoidy nebo v případě jejich neúnosných vedlejších účinků doporučuje BTS (British Thoracic Society) metotrexát jako lék první volby.[8]
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
- Mimoplicní sarkoidóza • Sarkoidóza/lymfatický systém • Sarkoidóza/srdce • Sarkoidóza/játra • Sarkoidóza/ledviny • Sarkoidóza/oči • Sarkoidóza/kůže • Sarkoidóza/nervy • Sarkoidóza/pohybový aparát • Hyperkalcémie u sarkoidózy • Sarkoidóza/krev
- Sarkoidóza (patologie)
- Intersticiální plicní procesy
- Plicní projevy u systémových chorob pojiva
- Tuberkulóza (pneumologie)
Externí odkazy[upravit | editovat zdroj]
Sarkoidóza - YouTube video
Zdroj[upravit | editovat zdroj]
ANTON, Jan. Materiály k přednášce "Sarkoidóza". (zkráceno)
Reference[upravit | editovat zdroj]
- ↑ HUNNINGHAKE, G W, U COSTABEL a M ANDO, et al. ATS/ERS/WASOG statement on sarcoidosis. American Thoracic Society/European Respiratory Society/World Association of Sarcoidosis and other Granulomatous Disorders. Sarcoidosis Vasc Diffuse Lung Dis [online]. 1999, vol. 16, no. 2, s. 149-73, dostupné také z <https://www.ncbi.nlm.nih.gov/pubmed/10560120>. ISSN 1124-0490.
- ↑ FREEMER, M a T E KING. The ACCESS study: characterization of sarcoidosis in the United States. Am J Respir Crit Care Med [online]. 2001, vol. 164, no. 10 Pt 1, s. 1754-5, dostupné také z <https://www.ncbi.nlm.nih.gov/pubmed/11734416>. ISSN 1073-449X.
- ↑ ENERSEN, Ole Daniel. Whonamedit? : A dictionary of medical eponyms. Kveim’ test [online]. [cit. 2011-10-01]. <http://www.whonamedit.com/synd.cfm/556.html>.
- ↑ a b c KOLEK, Vítězslav. Sarkoidóza. Postgraduální medicína [online]. 2006, roč. 6, vol. -, s. 656-663, dostupné také z <https://zdravi.euro.cz/clanek/postgradualni-medicina/sarkoidoza-280990>. ISSN 1212-4184.
- ↑ Wikipedia contributors. Kveim test [online]. Wikipedia, The Free Encyclopedia, [cit. 2011-10-01]. <https://en.wikipedia.org/w/index.php?title=Kveim_test&oldid=433485463>.
- ↑ ENERSEN, Ole Daniel. Whonamedit? : A dictionary of medical eponyms. Morten Ansgar Kveim [online]. [cit. 2011-10-01]. <http://www.whonamedit.com/doctor.cfm/600.html>.
- ↑ UTZ, James P, Andrew H LIMPER a Sanjay KALRA, et al. Etanercept for the treatment of stage II and III progressive pulmonary sarcoidosis. Chest [online]. 2003, vol. 124, no. 1, s. 177-85, dostupné také z <https://www.ncbi.nlm.nih.gov/pubmed/12853521>. ISSN 0012-3692.
- ↑ COKER, Robina Kate. Management strategies for pulmonary sarcoidosis. Ther Clin Risk Manag [online]. 2009, vol. 5, no. 3, s. 575-84, dostupné také z <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2724188/?tool=pubmed>. ISSN 1176-6336.