Akutní myeloidní leukemie
(přesměrováno z AML)
| Akutní myeloidní leukemie | |
| C92.6 | |
| 9840/3 | |
 Akutní promyelocytární leukemie (AML-M3). Patrná azurofilní granula. | |
| Lokalizace | kostní dřeň |
|---|---|
| Incidence v ČR | 15/100 000 |
| Maximum výskytu | 65 let |
| Terapeutické modality | chemoterapie, allogenní transplantace HSC |
Akutní myeloidní leukemie (AML) je maligní klonální onemocnění hematopoézy, charakterizované proliferací a akumulací nezralých myeloidních prekurzorů (blastů) v kostní dřeni a většinou i v periferní krvi. Důsledkem toho dochází k selhání krvetvorby – neutropenii, anémii a trombocytopenii. Je nejčastější akutní leukemií dospělých, u kterých incidence činí 15/100 000 obyvatel ročně. U dětí je vzácnější, incidence je asi 2–3/100 000 ročně. Medián věku v době stanovení diagnózy AML je 65 let.
Klasifikace[upravit | editovat zdroj]
Klasifikace podle WHO (2016) je založena na multiparametrickém přístupu, který integruje klinické, morfologické, imunofenotypové, cytogenetické a molekulárně genetické znaky:
- AML s rekurentními genetickými abnormalitami [1]
- AML s myelodysplastickými změnami
- AML v důsledku předchozí terapie
- AML nezařazená jinde (NOS) - FAB klasifikace
- AML s minimální diferenciací
- AML bez maturace
- AML s maturací
- akutní myelomonocytární leukemie
- akutní monoblastická a monocytární leukemie
- čistá erytroidní leukemie
- akutní megakaryoblastická leukemie
- akutní bazofilní leukemie
- akutní panmyelóza s myelofibrózou
- Myeloidní sarkom
- Myeloidní proliferace u Downova syndromu
Příčiny[upravit | editovat zdroj]
AML vzniká maligní transformací kmenové hematopoetické buňky, která se diferencuje v myeloidní nebo myelomonocytární blasty, vzácně v erytroidní nebo megakaryocytární blasty. Etiologie je multifaktoriální, mezi induktory patří ionizující záření a kancerogenní chemikálie (včetně cytostatik) – benzen, herbicidy, pesticidy, alkylační cytostatika, inhibitory topoizomerázy II. Zvýšený výskyt je u Fanconiho anémie, Kostmannova syndromu, Wiskottova-Aldrichova syndromu, Downova syndromu a Klinefelterova syndromu. Zásadní význam mají získané chromozomové přestavby a mutace, taktéž se ukazuje význam změn v epigenetické regulaci.
Projevy[upravit | editovat zdroj]
Onemocnění má prudký nástup a stav se rychle zhoršuje. Klinické příznaky jsou způsobeny kombinací anémie, neutropenie a trombocytopenie:
- malátnost, únava a pocit vyčerpání, bledost sliznic a kůže, u starších pacientů mohou být v krajních případech ischemické bolesti na hrudi nebo ischemický iktus,
- infekce, často s agresivním průběhem,
- subfebrilie až febrilie bez prokazatelné infekce,
- petechie, ekchymózy, krvácení z nosu a dásní,
- někdy hyperplazie dásní,
- vzácně kožní infiltráty nebo infiltrace měkkých tkání,
- projevy leukostázy při hyperleukocytóze - dušnost, poruchy zraku, rozličné neurologické příznaky.
Syndrom leukostázy
Hyperleukocytóza je hodnota leukocytů vyšší než 100 000/μl a je asociována s vyšší morbiditou a mortalitou. U pacientů s AML se můžou příznaky leukostázy projevit již při hodnotě 50 000/μl. Vysoký počet leukocytů vede ke zvýšení viskozity krve, obstrukci kapilár a následné hypoxii nebo krvácení při jejich ruptuře. To se projeví rozličnými neurologickými příznaky, poruchou zraku při hemoragii do sítnice, dušností, ischemií jiných orgánu nebo priapismem. U pacientů s hyperleukocytózou a projevy leukostázy provádíme leukaferézu a cytoredukci (hydroxyurea) s cílem předejít nebo zmírnit tyto příznaky a komplikace. V úvodu je nutná dostatečná hydratace. Jedná se o velmi akutní stav s nutností neprodleného řešení.
Syndrom tumorlýzy
Rozpad velkého množství buněk vedoucí k renální insuficienci, hyperkalémii, hyperfosfatémii a hyperurikémii. Nastává při zahájení léčby, nebo i spontánně. Léčbou je dostatečná i.v. hydratace, alopurinol, rasburikáza, případně přístrojová náhrada renálních funkcí (hemodialýza).
Diseminovaná intravaskulární koagulace (DIC)
Jedná se o život ohrožující stav, který je charakterizován rozsáhlou aktivací koagulační kaskády, která vede k vzniku mnohočetných trombů. Dochází k ischemií orgánů a následně zvýšené krvácivosti (konzumpční koagulopatie). Nejvýraznější bývá u akutní promyelocytární leukemie a u akutní monocytární leukemie. Podává se heparin a koagulační faktory.
Diagnostika[upravit | editovat zdroj]
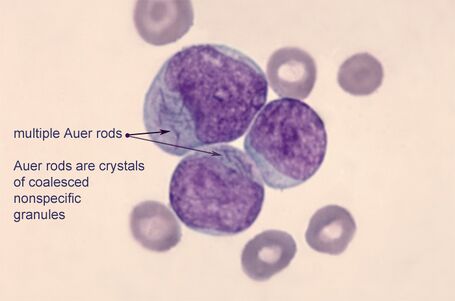
V krevním obraze anémie, trombocytopenie, počet leukocytů může být zvýšený, snížený, nebo i v normě. Diagnóza je stanovena na základě nálezu 20 % myeloidních blastů v nátěru aspirátu kostní dřeně (myelogramu) ze sternální punkce. Většinou jsou blasty detekovatelné i v periferní krvi. Typický hiatus leucaemicus (absence mezistupňů vývoje granulocytů - promyelocytů, myelocytů a metamyelocytů). Častá je přítomnost Auerových tyčí (azurofilní protáhlé inkluze), především u akutní promyelocytární leukemie, kde jsou velké atypické promyelocyty se snopci Auerových tyčí – tzv. faggot cells. Myeloidní původ blastů je určen průtokovou cytometrií aspirátu kostní dřeně či periferní krve, nebo u ložiskových infiltrátů pomocí imunohistochemie. Cytogenetická a molekulárně genetická vyšetření jsou nutná pro určení prognózy.
V laboratorním vyšetření může být dále elevace laktátdehydrogenázy (LD) a C-reaktivního proteinu (CRP), koagulopatie s prodloužením PT a aPTT a zvýšená hladina D-dimerů.
AML se dělí do prognostických skupin dle cytogenetického a molekulárně biologického nálezu podle ELN (2017):
- Příznivá
- Střední
- Nepříznivá
Minimální zbytková nemoc
Minimal residual disease (MRD) je název pro minimální množství leukemických buněk, které zůstaly v těle po terapii. Je jednou z hlavních příčin relapsů a důležitý prognostický faktor. K detekci se využívá qRT-PCR kvantifikace transkriptů rekurentních fúzních genů. Pokud u pacienta fúzní gen není, používá se flowcytometrie.
Léčba[upravit | editovat zdroj]
Léčba AML je založená na intenzivní indukční chemoterapii s následnou postremisní chemoterapii, nebo alogenní transplantaci krvetvorných buněk. Transplantace má však významnou peritransplantační mortalitu (20–30%). Pacienti do 65 let jsou obvykle léčeni s kurativním záměrem, u starších je vhodné zvážit komorbidity, schopnost tolerovat intenzivní chemoterapii a prognostické faktory.
Intenzivní léčba (pacienti do 65 let bez komorbidit)[upravit | editovat zdroj]
- Indukční léčba – kombinace 3 dnů daunorubicinu a 7 dní cytarabinu (režim “3+7”).
U pacientů s CD33 pozitivní AML v příznivé nebo střední rizikové skupině se přidává gemtuzumab ozogamicin (anti-CD33 monoklonální protilátka konjugovaná s cytotoxickým kalicheamicinem).
U pacientů s mutacemi FLT3 se přidává midostaurin (inhibitor FLT3).
V případě nedosažení kompletní remise se podává 2. cyklus. Pacienti, kteří nedosáhnou remise ani po 2. cyklu, mají obvykle špatnou prognózu. Za kompletní remisi považujeme stav, kdy je počet blastů v kostní dřeni pod 5 % a počet neutrofilů nad 1x10^9/l a není nutno podávat krevní transfuze.
- Postremisní léčba - odvíjí se od prognostické skupiny podle cytogenetického a molekulárně biologického rizika:
- Příznivá – 2–3 cykly konsolidační chemoterapie. V případě relapsu či přetrvávající minimální zbytkové nemoci alogenní transplantace krvetvorných kmenových buněk.
- Střední – alogenní transplantace krvetvorných kmenových buněk nebo konsolidační chemoterapie, může být nutné podat 1–2 cykly konsolidační chemoterapie během vyhledávání dárce.
- Nepříznivá – alogenní transplantace krvetvorných kmenových buněk, případně 1–2 cykly konsolidační chemoterapie během vyhledávání dárce.
Paliativní a symptomatická léčba (pacienti nad 65 let nebo s komorbiditami)[upravit | editovat zdroj]
- nízkodávkový cytarabin
- 5-azacytidin
- decitabin
- venetoclax
- glasdegib
- symptomatická terapie u pacientů v celkově špatném stavu
Podpůrná léčba obsahuje profylaxi antibiotiky a antimykotiky (imunodeficit), substituce erytrocytů a trombocytů, hormonální zástava menstruace a ovariální protekce (riziko závažného krvácení a sterility po chemoterapii).
Léčba relapsu nebo refrakterního onemocnění[upravit | editovat zdroj]
Záchranné chemoterapeutické režimy (FLAG, FLAG-IDA nebo MEC), gilteritinib a quizartinib u mutací FLT3, ivosiednib u mutací IDH1, enasidenib u mutací IDH2, nové léky v klinických studiích. Vždy je nutno provést alogenní transplantaci krvetvorných kmenových buněk, jinak je pravděpodobnost udržení remise nízká.
Diferenciální diagnostika[upravit | editovat zdroj]
Shodné nebo podobné příznaky mohou mít:
- akutní lymfoblastická leukemie
- myelodysplatický syndrom (počet blastů do 20%)
- aplastická anemie
- jiné leukemie a lymfomy
- primární myelofibróza
- infiltrace kostní dřeně buňkami karcinomů
- lékově podmíněné poškození kostní dřeně
- infekční mononukleóza
Prognóza[upravit | editovat zdroj]
Prognóza je variabilní a závislá od cytogeneticko-molekulárních změn a klinických faktorů (věk, odpověď na chemoterapii, vstupní stav). Nemocní do 60 let dosahují kompletní remise v 60–80 % a celkové 5leté přežití se pohybuje kolem 50 %. U starších pacientů bývá kompletní remise v 50 %, celkové 5leté přežití jenom 20 %. Po použití alogenní transplantace je 3leté přežití vyšší než 50 %. Na symptomatické léčbě se pacienti dožívají pouze několika týdnů až měsíců.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
- Leukemie
- Akutní lymfoblastická leukemie
- Akutní promyelocytární leukemie
- Chronická myeloidní leukemie
- Chronická lymfatická leukemie
- Leukemie z vláskových buněk
Reference[upravit | editovat zdroj]
- BÜCHLER, Tomáš. Speciální onkologie. 2. vydání. Praha: Maxdorf, [2020]. Jessenius. ISBN 978-80-7345-651-1.
- DOUBEK, Michael, MAYER, Jiří (Eds.). Léčebné postupy v hematologii 2020. Doporučení České hematologické společnosti České lékařské společnosti Jana Evangelisty Purkyně. 1. vyd. 2020. ISBN 978-80-270-8240-7.