Vybraná biochemická vyšetření u pacientů s diabetes mellitus (1. LF UK, VL, 2. roč.)
(přesměrováno z Vybraná biochemická vyšetření u pacientů s diabetes mellitus)
Poruchy energetického metabolismu, především obezita, diabetes mellitus, stavy, které diabetu předcházejí (prediabetes) a tzv. metabolický syndrom, mají mimořádný medicínský význam. Jen diabetes dnes postihuje kolem 10 % obyvatel vyspělých zemí a jeho incidence stále roste. Přitom jde o onemocnění, které je spojené s velkým množstvím komplikací a dramaticky zvyšuje úmrtnost i nemocnost. Porozumění diabetu a znalost principů jeho diagnostiky a léčby je proto zásadní pro každého zdravotnického profesionála.
Regulace glykémie
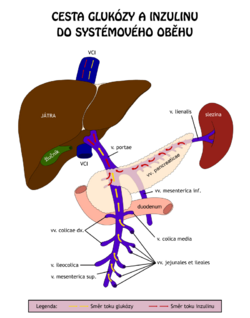
Koncentrace glukózy v krvi (glykémie) je za fyziologických podmínek udržována v úzkém rozmezí hodnot 3,9–5,6 mmol/l nalačno a po jídle nižší než 10 mmol/l. Je přísně regulována řadou mechanismů: inzulinem, který glykémii snižuje, a antiinzulinárně působícími hormony − glukagonem, katecholaminy, glukokortikoidy a růstovým hormonem, které glykémii zvyšují. Na regulaci glukózové homeostázy se dále významně podílejí játra. Udržení stálé hodnoty glykémie je nezbytné pro činnost CNS a jiných tkání a buněk (např. erytrocytů).
Zdroje glukózy
Exogenním zdrojem glukózy pro organismus jsou disacharidy a polysacharidy obsažené v potravě. Glukóza vzniká jejich rozštěpením v tenkém střevě a je utilizována v játrech, svalech, tukové a mozkové tkáni jako přímý zdroj energie. Nezoxidovaná glukóza se uskladňuje ve formě glykogenu, nebo se přeměňuje na mastné kyseliny a triacylglyceroly. Nalačno se normální koncentrace glukózy udržuje štěpením glykogenu glykogenolýzou a tvorbou glukózy z nesacharidových prekurzorů (aminokyselin, glycerolu a laktátu) v procesu glukoneogeneze.
Změny koncentrace glukózy v krvi
- Pokles glykémie s klinickými příznaky (hlad, poruchy chování, vědomí, křeče ...) se označuje jako hypoglykémie. Při hypoglykémii je ohroženo zásobování mozkové tkáně glukózou. Může se vyskytovat v průběhu různých onemocnění, nejčastěji při předávkování antidiabetik, vzácněji při dlouhodobém hladovění, u některých endokrinně aktivních nádorů nebo u dědičných metabolických poruch, které zasahují i metabolismus glukózy (např. při glykogenózách). Těžší hypoglykémie je provázena neklidem, opocením a třesem, při dalším poklesu glykémie dochází k poruše vědomí.
- Glykémie zvýšená nad referenční rozmezí se označuje jako hyperglykémie. Chronická hyperglykémie je základním projevem diabetu. Můžeme se však setkat i s přechodnou nediabetickou hyperglykémií. Vedou k ní všechny situace, kdy je zvýšená hladina katecholaminů, glukokortikoidů a dalších stresových hormonů, včetně řady akutních onemocnění. Změna regulace metabolismu glukózy vedoucí k hyperglykémii provází také zánětlivé stavy. Hyperglykémie může být vyvolána i iatrogenně, nejčastěji jako důsledek léčby pomocí steroidních hormonů a jejich analog.
- Výrazná hyperglykémie vede ke ztrátám glukózy do moči, neboť je překročen tzv. resorpční práh glukózy v renálních tubulech. V důsledku toho se zvyšují i ztráty vody, kterou glukóza s sebou osmoticky strhává, a některých iontů. Rozvíjí se proto dehydratace, hypovolémie, hyperosmolarita a iontová dysbalance. Hyperglykémie a hyperosmolarita extracelulárních tekutin současně vede i k poruchám transportních mechanismů na plazmatických membránách buněk. Tím dojde i ke zhroucení energetického metabolismu tkání, dochází ke zvýšenému odbourávání mastných kyselin a k nadprodukci ketolátek a rozvíjí se ketoacidóza. Těžká hyperglykémie pak vede k
nechutenství,
nevolnosti a
poruchám vědomí se
zmateností.
Diabetes mellitus
Diabetes mellitus (DM, úplavice cukrová) je chronické metabolické onemocnění s vysokou morbiditou a mortalitou, jehož hlavním a společným projevem je hyperglykemie vzniklá v důsledku absolutního či relativního nedostatku inzulinu. V posledních desetiletích byl zaznamenáván výrazný a setrvalý nárůst, hovoří se také o epidemii či pandemii diabetu. Příčina tohoto jevu tkví v životním stylu populace ekonomicky rozvinutých zemí (nadměrný energetický příjem, snížená fyzická aktivita).
V současnosti je v Česku evidováno více než 9 % osob s diabetem (1 045 600 v r. 2019[1]). Předpokládá se, že dalších 5 % populace zůstává nediagnostikováno. Nejčastěji se jedná o DM 2. typu (93 % případů), DM 1. typu tvoří asi 5 %, a ostatní typy jsou spíše vzácné.[2]
Klasifikace diabetu
- Diabetes mellitus 1. typu
- autoimunitně podmíněný,
- typ LADA (rozvíjí se v pozdějším věku, průběhem může připomínat DM 2. typu),
- idiopatický.
- Diabetes mellitus 2. typu
- s převažující inzulinorezistencí,
- s převažující poruchou sekrece inzulinu.
- Ostatní specifické typy DM
- pankreatoprivní DM (zničení β-buněk při chronické pankreatitidě, resekcí, traumatem, při cystické fibróze, hemochromatóze),
- DM při endokrinopatiích (akromegalie, glukagonom, feochromocytom, hyperkortizolismus, hypertyreóza atd.),
- DM vyvolaná léky a chemikáliemi (glukokortikoidy, kyselina nikotinová, hormony štítné žlázy),
- monogenně podmíněné formy (MODY)
- další vzácnou formou DM je hepatogenní diabetes
- Gestační diabetes mellitus se objeví v těhotenství a spontánně odezní v průběhu šestinedělí.
Prediabetes
Klinicky vyjádřenému diabetu mellitu s chronickou hyperglykémií často předchází období označované jako prediabetes. Nacházíme v něm již významné biochemické odchylky, avšak ještě nejsou splněna kritéria pro diagnózu diabetu. Mezi stavy označované jako prediabetes patří zejména:
- zvýšená glykemie nalačno (IFG – impaired fasting glucose);
- porucha glukózové tolerance (IGT – impaired glucose tolerance).
Patogeneze
K narušení glukózového metabolismu dochází:
- poruchou tvorby nebo sekrece inzulinu (deficit inzulinu);
- poruchou působení inzulinu (inzulinová rezistence);
- kombinací obou mechanismů;
- nebo vzácně poruchou jiného mechanismu, který reguluje glykémii.
Nedostatečná funkce inzulinu způsobí narušení transportu glukózy z krve do buňky, což vede k hyperglykémii a zároveň nedostatku glukózy intracelulárně. Nedostatečná utilizace glukózy vede ke změně mechanismů pro zisk ATP. Dochází ke stimulaci glukoneogeneze a glykogenolýzy, v adipocytech se zvyšuje lipolytické štěpení triacylglycerolů na mastné kyseliny a glycerol. Odbouráváním mastných kyselin oxidací vzniká nadbytečný acetyl-CoA, z něhož vznikají v játrech ketolátky (acetacetát, 3-hydroxybutyrát a aceton). Acetacetát může sloužit jako zdroj energie pro činnost svalů a mozku místo glukózy.
Jestliže tvorba ketolátek překročí jejich utilizaci periferními tkáněmi, rozvíjí se ketoacidóza. Vzhledem k tomu, že ketolátky jsou rozpustné ve vodě a vylučují se močí, nastává ketonurie. Při překročení prahové plazmatické koncentrace glukózy (10-12 mmol/l)[3] dojde k narušení transportní kapacity proximálního tubulu, a glukóza se tak dostává do finální moči. Glukóza i ketolátky jsou osmoticky aktivní, strhávají tak s sebou do moči i větší množství vody, což je podkladem polyurie.
Klinický obraz
Z výše uvedeného vyplývají i charakteristické příznaky DM jako je žízeň, polydipsie, osmotická
polyurie, nekonstantně přítomné
nechutenství a
úbytek hmotnosti způsobený ztrátou tekutin, snížením příjmu potravy a negativní energetickou bilancí při velkých ztrátách glukózy močí.
Komplikace
Diabetes mellitus vede ke zvýšení nemocnosti i úmrtnosti v důsledku svých komplikací. Extrémní vzestup glykémie vede ke změně osmolarity extracelulárního prostředí a tím k selhání řady transportních dějů a k metabolickému rozvratu. Podobně nedostatek glukózy intracelulárně v inzulin-dependentních tkáních vede zejména u plně vyjádřeného diabetu 1. typu ke zhroucení metabolických a fyziologických dějů. Tyto komplikace jsou akutní, dochází k nim bezprostředně v důsledku výrazné hyperglykémie. Podobně k akutním komplikacím vede těžká hypoglykémie, která vzniká nejčastěji neadekvátní hypoglykemizující léčbou (např. podání nesnížené dávky inzulinu pacientovi, který přestal přijímat potravu). Hypoglykemie postihne především orgány energeticky závislé na glukóze, v první řadě centrální nervový systém, a projevuje se tedy poruchou vědomí.
Nebezpečné jsou i chronické komplikace diabetu, které se rozvíjejí mnohdy plíživě v důsledku neenzymové glykace proteinů, tvorby pokročilých produktů glykace (AGE), vstupu glukózy do alternativních metabolických drah a vzniku méně obvyklých produktů (např. sorbitolu) apod. Mezi pozdní, chronické komplikace diabetu patří např. makroangiopatie (akutní infarkt myokardu, cévní mozkové příhody, ischemická choroba dolních končetin a další choroby tepen), mikroangiopatie (včetně retinopatie, glomerulopatie apod.) a neuropatie (zejména periferní neuropatie). Postiženy ale mohou být prakticky všechny tkáně.
Diabetes mellitus 1. typu
Diabetes mellitus 1. typu je charakterizován absolutním nebo téměř úplným nedostatkem endogenního inzulinu a životní závislostí na podávání exogenního inzulinu. Nemocní mají sklon ke ketoacidóze.
Onemocnění vzniká v důsledku selektivní destrukce β-buněk Langerhansových ostrůvků pankreatu autoimunitním procesem u geneticky predisponovaných jedinců. Spouštěcím mechanismem autoimunitního děje je pravděpodobně virová infekce či kontakt s jiným exogenním nebo endogenním agens.
Klinický obraz diabetu mellitu 1. typu závisí na agresivitě autoimunitního procesu. V dětství a dospívání, kdy se rozvíjí většina onemocnění, bývá poslední fáze destrukce β-buněk velmi rychlá, takže se diabetes manifestuje klasickými akutními příznaky (včetně ketoacidózy). V pozdějším věku mívá onemocnění podstatně pomalejší nástup a až po čase vyústí v úplnou závislost na inzulinu. Sekrece inzulinu může být i několik let sice snížená, ale dostačující k tomu, aby zabránila ketoacidóze. Klinický průběh onemocnění proto připomíná diabetes mellitus 2. typu a uvádí se, že asi každý desátý nemocný původně klasifikovaný jako diabetik 2. typu má pomalu probíhající diabetes 1. typu – latentní autoimunní diabetes dospělých (latent autoimmune diabetes of adults – LADA)[4].
DM 1. typu je méně častou formou diabetu, která se vyskytuje asi u 7 % diabetiků. Klasickými příznaky DM 1. typu jsou žízeň, polyurie a úbytek hmotnosti.
Udává se také, že DM 1. ve spojitosti se vznikem tyreopatie (onemocnění štítné žlázy) představuje významný rizikový faktor. Např. hypotyreóza úzce souvisí s vyšším rizikem vzniku metabolického syndromu. Hormony štítné žlázy značně ovlivňují inzulínovou senzitivitu na periferních tkáních. Přítomnost tyreopatie je nezbytné zohlednit při antidiabetické medikaci.
| Diabetes mellitus 1. typu | Diabetes mellitus 2. typu | |
|---|---|---|
| LADA | ||
| chybí sekrece inzulinu | postupný zánik sekrece inzulinu | inzulinová rezistence, porucha sekrece inzulinu |
| typický začátek v dětství a dospívání | typický začátek v dospělosti | typický začátek po 40 letech |
| ketoacidóza | ||
| častěji nižší BMI | častěji vyšší BMI | |
| pozitivní autoprotilátky | autoprotilátky chybí | |
| C-peptid chybí | C-peptid snížený | C-peptid normální nebo zvýšený |
| imunoreaktivní inzulin chybí | imunoreaktivní inzulin snížený | imunoreaktivní inzulin normální nebo zvýšený |
Diabetes mellitus 2. typu
Gestační diabetes
Gestační diabetes mellitus (GDM) je porucha metabolismu glukózy různého stupně závažnosti, která se poprvé projeví během těhotenství a obvykle spontánně ustoupí během šestinedělí. Kromě GDM může být v těhotenství diagnostikován i tzv. zjevný (pregestační) diabetes mellitus, který přetrvává i po šestinedělí.
Rizikové faktory
Mezi rizikové faktory gestačního diabetu patří:
- diabetes mellitus II. typu v rodinné anamnéze,
- gestační diabetes v minulém těhotenství,
- nadváha nebo obezita,
- nedostatek pohybové aktivity,
- vyšší věk,
- PCO syndrom,
- hypertenze.
Samotný gestační diabetes představuje významný rizikový faktor pro rozvoj diabetu 2. typu v budoucnu – DM II.typu postihuje až 40–60 % žen s anamnézou GDM, riziko je přibližně sedmkrát vyšší než u žen bez této diagnózy.
Následky
V kombinaci s rizikovými faktory hormony placenty a mateřská tuková tkáň způsobují rozvoj inzulinové rezistence a následné hyperglykémii matky. Ta vyvolává hyperinzulinismus plodu, jehož důsledkem je diabetická fetopatie – soubor poruch způsobených nadměrnou inzulinovou odpovědí plodu, mezi které patří:
- makrosmie plodu se zvyšeným rizikem porodního traumatismu,
- neonatální hypoglykémie,
- nezrálost plíc v důsledku poruchy produkce surfaktantu,
- rozvoj hypertrofické kardiomyopatie,
- prolongovaná novorozenecká žloutenka.
Kromě bezprostředních následků ovlivňuje tento stav dítě také na epigenetické úrovni, čímž zvyšuje riziko rozvoje metabolického syndromu a kardiovaskulárních onemocnění v pozdějším věku.
Screening
Screening gestačního diabetu se provádí u všech těhotných žen cestou obvodního gynekologa.
První vyšetření probíhá do 14. týdne těhotenství stanovením glykémie nalačno z žilní krve (nikoli měřením glykometrem).
| Hodnota glykémie | Interpretace |
|---|---|
| < 5,1 mmol/l | normální nález |
| ≥ 7,0 mmol/l | zjevný diabetes – test se neopakuje |
| ≥ 5,1 mmol/l a < 7,0 mmol/l | opakovat vyšetření následující den |
| ≥ 5,1 mmol/l při opakovaném testu | gestační diabetes mellitus |
Další fáze screeningu gestačního diabetu probíhá mezi 24+0 a 27+6 týdnem těhotenství, opět vyšetřením glykémie nalačno z žilní krve. Hodnoty se interpretují obdobně jako při prvním screeningu. V případě, že je hodnota glykémie nalačno < 5,1 mmol/l, pokračuje se provedením orálního glukózového tolerančního testu (oGTT). Těhotná žena při něm vypije 75 g glukózy rozpuštěných ve 200 ml vody a následně se měří hladina glykémie dvakrát – 60 minut a 120 minut po vypití roztoku. Hodnoty glykémie ≥ 10 mmol/l po 60 minutách nebo ≥ 8,5 mmol/l po 120 minutách svědčí o gestačním diabetu.
Terapie a management
Ve většině případů gestačního diabetu stačí dodržovat režimová opatření – stravovací doporučení, dostatek pohybu a pravidelný selfmonitoring glykémie. Pokud tato opatření nejsou dostatečně účinná, přistupuje se k farmakologické terapii metforminem![]() nebo inzulinem[5], přičemž oba léky by měly být před porodem vysazeny.
nebo inzulinem[5], přičemž oba léky by měly být před porodem vysazeny. ![]() Metformin je během kojení kontraindikován, zatímco inzulin může být bezpečně použit i během kojení, například u pacientek s pregestačním diabetem.
Metformin je během kojení kontraindikován, zatímco inzulin může být bezpečně použit i během kojení, například u pacientek s pregestačním diabetem.
Následující management gestačního diabetu je odvozen od zařazení pacientky do příslušné rizikové skupiny:
- Low-risk: postačují režimová opatření, případně metformin do 1000 mg/den nebo inzulin do 10 jednotek/den. U této skupiny není indikace k předčasnému ukončení těhotenství.
- High-risk: metformin nad 1000 mg/den, inzulin nad 10 jednotek/den nebo přítomnost klinických komplikací (např. hypertenze, obezita, abnormální růst plodu). U těchto pacientek není doporučeno přenášet těhotenství.
Základní biochemická vyšetření u pacientů s diabetes mellitus
Stanovení koncentrace glukózy v krvi je vyšetřením, které poskytne základní informaci o sacharidovém metabolismu. Odebírá se kapilární nebo venózní krev a glukóza se stanovuje v plné krvi, plazmě nebo séru. Při stanovení glukózy v plné krvi jsou hodnoty o 10–15 % nižší (v závislosti na hematokritu), v arteriální krvi jsou o 10 % vyšší než ve venózní (arteriovenózní rozdíl). Pro zabránění glykolýzy se do odběrových nádobek přidává NaF (2,5 mg na 1 ml plné krve).
Vyšetření koncentrace glukózy v krvi má potřebnou informační hodnotu pouze tehdy, pokud je znám časový interval mezi odběrem krve a příjmem potravy.
Vyšetření glykémie se provádí:
- nalačno (krev se odebírá nejméně 8 hodin po příjmu potravy) – indikováno při vyhledávání diabetiků a určení diagnózy DM;
- náhodně naměřená glykémie (krev se odebírá bez udání časového vztahu k příjmu potravy) – provádí se při podezření na hypoglykémii nebo hyperglykémii;
- po jídle – postprandiální glykémie (1 hodinu po jídle obsahujícím sacharidy) – indikováno při kontrole účinnosti léčby DM;
- jako glykemický profil – glykémie se stanovuje několikrát denně, obvykle před hlavními jídly, někdy i po jídle a v noci.
Metody stanovení glykémie
Stanovení glykémie v laboratorních podmínkách
Ke stanovení koncentrace glukózy se používají různé metody. Rozšířené jsou metody enzymové. Glukózu můžeme stanovit pomocí každého enzymu, který ji metabolizuje.
Glukózaoxidázová reakce
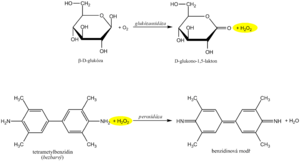
Doporučená rutinní metoda využívá spřažených enzymových reakcí glukózaoxidázy (GOD, EC 1.1.3.4) a peroxidázy (POD, EC 1.11.1.7). V první reakci enzym glukózaoxidáza katalyzuje oxidaci glukózy vzdušným kyslíkem za vzniku glukonolaktonu. Je známo, že v roztoku je 36 % glukózy ve formě α-anomeru a 64 % ve formě β-anomeru. GOD je vysoce specifická pro β-D-glukopyranosu. Aby se mohly oxidovat oba anomery, je nutná mutarotace α- na β-anomer, ke které dojde spontánně v průběhu dostatečně dlouhé inkubace. Jako vedlejší produkt glukózaoxidázové reakce se vytváří ekvimolární množství peroxidu vodíku.
V další reakci katalyzované peroxidázou reaguje vznikající peroxid vodíku s vhodným chromogenem, který se oxiduje na reaktivní meziprodukt, a ten s další látkou kopuluje na stálé rozpustné barvivo. Příkladem může být oxidační kopulace derivátu fenolu se 4-aminoantipyrinem na červené barvivo, jehož absorbance se po ustálení reakční rovnováhy měří.
Jiné metody využívají měření úbytku kyslíku, ke kterému dochází v průběhu reakce katalyzované glukózaoxidázou a který můžeme sledovat elektrochemicky kyslíkovou elektrodou nebo enzymovou elektrodou.
Hexokinázová reakce
Vysokou specifitou se vyznačuje metoda hexokinázová. Hexokináza (EC 2.7.1.1) fosforyluje glukózu v přítomnosti ATP na glukóza-6-fosfát. V dalším kroku se glukóza-6-fosfát oxiduje pomocí glukóza-6-fosfátdehydrogenázy proti NADP+ na 6-fosfoglukonolakton. Redukci NADP+ na NADPH lze vyhodnocovat přímou fotometrií v UV oblasti na principu Warburgova optického testu.
Stanovení glykémie v mimolaboratorních podmínkách
Glykémie patří mezi parametry, které se často vyšetřují i bez laboratorního zázemí. Rychlé orientační stanovení glykémie je běžné v urgentní péči. U pacientů léčených inzulínem se také s výhodou pravidelně sleduje glykémie pomocí osobního glukometru a na základě naměřených hodnot se upravuje léčba. Koncentrace glukózy v krvi patří mezi parametry nejčastěji stanovované technikami vyšetření v místě péče o pacienta (point of care testing, POCT). Nutno ovšem mít na paměti, že metody POCT, jakkoli zlepšují kvalitu péče i komfort nemocného, nenahrazují pravidelné lékařské vyšetření ani laboratorní kontroly.
Metody rychlého stanovení glykémie využívají několika principů. Výchozím materiálem je obvykle kapka plné kapilární krve, která se aplikuje na testovací proužek.
Nejstarší proužky byly založeny na stejných reakcích jako fotometrické měření koncentrace glukózy. Reakční zóna obsahovala glukózaoxidázu, peroxidázu a vhodný chromogen. Vyhodnocení se provádělo buď vizuálně srovnáním s barevnou stupnicí, nebo pomocí glukometru – jednoúčelového reflexního fotometru.
Většina glukometrů dnes využívá enzymové elektrody[6] [7].
Senzory první generace se objevily již v šedesátých letech 20. století. Nejstarší systém byl založen na glukózaoxidázové reakci. Využíval dvou elektrod, jedna byla pokrytá enzymem. Koncentrace kyslíku ve vzorku a rychlost jejího poklesu v průběhu reakce se měřila tzv. Clarkovou metodou: kyslík se redukuje na platinové katodě, intenzita proudu mezi katodou a anodou odpovídá jeho koncentraci:
- O2 + 4 H+ + 4 e- → 2 H2O
Později se namísto spotřeby kyslíku stanovovala elektrochemicky produkce peroxidu vodíku. I v tomto případě jde o jednoduchou elektrochemickou reakci, tentokrát probíhající na anodě:
- H2O2 → O2 + 2 H+ + 2 e-
Takto konstruované analyzátory byly jednodušší a bylo možné je více miniaturizovat. Ampérometrické měření podukce peroxidu vodíku je ovšem ovlivněno řadou látek: askorbátem, kyselinou močovou, mnohými léčivy apod. Jiným problémem mnohých senzorů první generace byla závislost výsledků měření na nasycení vzorku kyslíkem.
Senzory druhé generace jsou rovněž založeny na glukózaoxidázové reakci, namísto molekulárního kyslíku je však akceptorem elektronů jiná látka – tzv. mediátor. Jinou možností je oxidace glukózy na glukonolakton jiným bakteriálním enzymem, glukózadehydrogenázou, přičemž elektrony se opět přenášejí na vhodný mediátor. Redukovaný mediátor se v obou případech znovu oxiduje na anodě a měří se buď proud protékající mezi katodou a anodou (ampérometrické stanovení), nebo výsledný náboj anody (coulumbometrické stanovení). Používá se řada konkrétních uspořádání testovacích proužků, jako mediátory se využívají různé látky (např. kyanoželezitan, hexamin ruthenia, komplexy osmia, fenantrolinchinon).
Měření glykémie v reálném čase bez opakovaných odběrů krve umožňují novější senzory, které měří koncentraci glukózy kontinuálně (CGM) (nebo v krátkých časových intervalech). Jsou založené také na enzymové elektrodě, která se jednou za několik dní zavádí do podkoží. Měří koncentraci glukózy v tkáňovém moku; ta odpovídá glykémii velmi dobře, mění se oproti glykémii s několikaminutovým zpožděním. Enzymová elektroda bývá zabudována v jednom těle s elektronikou, která vyhodnocuje naměřená data a umožňuje jejich bezdrátový přenos do čtečky nebo mobilního telefonu.
Vyvíjejí se i další metody, které umožňují měřit glykémii i neinvazivně, bez odběru krve. Jsou nejčastěji založené na optických metodách – spektroskopii v blízké infračervené oblasti (NIR spektroskopie) či Ramanově spektroskopii, nebo využívají i dalších změn fyzikálních vlastností tkání v závislosti na glykémii.
Orální glukózový toleranční test
Orální glukózový toleranční test (oGTT) odráží reakci organismu na podání glukózy fyziologickou cestou a hodnotí, zda je organismus schopen po zátěži glukózou udržet její hladinu v krvi v normálním rozmezí. Je sumou informací nejen o účincích hormonů regulujících glykémii, ale též o procesech v gastrointestinálním traktu (rychlost vyprazdňování žaludku, pasáž střevem a resorpce) a jaterních funkcích.
Orální glukózový toleranční test se používá především pro včasnou diagnózu gestačního diabetu. V tomto případě se používá jako rutinní skríninkové vyšetření, prováděné u všech těhotných na přelomu druhého a třetího trimestru (při vysokém riziku navíc i co nejdříve po zjištění těhotenství).
U ostatních osob se orální glukózový toleranční test doporučuje jako doplňující diagnostická zkouška pro diagnostiku DM, pokud nelze rozhodnout podle hodnot glykémie nalačno a náhodné glykémie (zejména pokud je glykémie nalačno mezi 5,6–7,0 mmol/l)[8]. Pokud jsou hodnoty glykémie nalačno nebo náhodné glykémie průkazné pro diagnózu DM, byl by oGTT zbytečnou zátěží pro pacienta, a je proto kontraindikován. Dále se neprovádí u akutně nemocných a imobilizovaných pacientů ani u nemocných na redukční dietě.
Provedení oGTT
- 3 dny před testem neomezujeme příjem sacharidů (nejméně 150 g/den) a nemocný vykonává obvyklou tělesnou námahu;
- po 8–14hodinovém lačnění se odebere vzorek krve nalačno;
- pacient vypije 75 g glukózy rozpuštěné ve 250–300 ml čaje nebo vody během 5–10 minut;
- během vyšetření zůstává pacient sedět a nekouří;
- další vzorek krve se odebírá u těhotných v 60. a 120. minutě, u všech ostatních pacientů jen ve 120. minutě po zátěži glukózou.[9].
Pro oGTT se vždy odebírá žilní krev, nelze použít kapilární krev − měření by bylo zatížené příliš velkou chybou. Pokud stanovení glykémie nelze v laboratoři provést do 30 minut od odběru, odebírá se krev do zkumavek s inhibitorem glykolýzy (fluoridem sodným), jinak by mohly být výsledky ovlivněné spotřebou glukózy v již odebraném vzorku bílými krvinkami.[10]
Kromě výše uvedeného způsobu oGTT se může provádět ještě podrobnější tzv. glykemická křivka, kdy se krev odebírá vícekrát, zpravidla ve 30 minutových intervalech.
V průběhu glykemické křivky můžeme popsat tři úseky:
- Glukóza se po podání per os vstřebává ve střevě a glykémie se zvyšuje – vzestupná část. Po gastrektomii bývá strmá, při malabsorpci plochá. V důsledku zvýšení glykémie se podněcuje oxidace glukózy ve svalech a v játrech se tvoří glykogen.
- Funkci jater a účinky inzulinu v játrech odráží další – vrcholová část glykemické křivky. U začínajícího DM není glukóza v játrech dostatečně přeměňována na glykogen, a proto vrchol glykemické křivky přesahuje hodnotu 11,1 mmol/l a maximum nastává i později než za 60 minut. Při onemocnění jater je vrcholová část křivky rovněž změněna. Hepatocyty nestačí vstřebanou glukózu zmetabolizovat, takže do periferie přechází více glukózy. Vrchol rovněž převyšuje hodnotu 11,1 mmol/l a zvýšení přetrvává déle než 60 minut, ale na rozdíl od DM se ve 120. minutě vrací k normě (zvonový tvar křivky). U hypertyreózy je v důsledku rychlého vstřebávání také překročena hladina 11,1 mmol/l, ale pokles je rychlý (gotický tvar křivky).
- Sestupná část je závislá na účincích inzulínu a fyziologicky je charakterizována poklesem hladiny glukózy. Zpomalený a nedostatečný návrat glykémie k normě je klasickým projevem DM.
Normálně pozorujeme maximální vzestup za 30–60 minut, nedochází ke glykosurii a po 2 hodinách se glykémie vrací k hodnotám nalačno.
Obecně je oGTT zatížen velkou náhodnou chybou a nízkou reprodukovatelností.
Hodnocení glykémie a oGTT
Zdravé osoby mají plazmatickou glykémii nalačno < 5,6 mmol/l, při oGTT mají glykémii ve 120. minutě < 7,8 mmol/l.
Pro diagnózu DM svědčí
- glykémie nalačno > 7,0 mmol/l, nebo
- náhodná glykémie > 11,1 mmol/l spolu s klasickými příznaky diabetu, nebo
- glykémie > 11,1 mmol/l ve 120. minutě oGTT.
Pro potvrzení diagnózy DM je zapotřebí opakované vyšetření z dalšího odběru v některém z příštích dnů.
Pokud výsledky oGTT neodpovídají ani normální glykemické křivce, ani diagnóze DM, jde nejčastěji o některou z forem prediabetu:
- Zvýšená glykémie nalačno (impaired fasting glucose, IFG) je definována lačnou glykémií v rozmezí 5,6 až 6,9 mmol/l.
- Porucha glukózové tolerance (impaired glucose tolerance, IGT) je charakterizována glykémií ve 120. minutě standardně provedeného oGTT v rozmezí 7,8 až 11,0 mmol/l.[11]
Glykované proteiny
Přímým důsledkem zvýšené hladiny cukru v krvi je jeho intenzivní vazba na proteiny, jež je podstatou neenzymové glykace. Proces glykace je podmíněn přítomností volných aminoskupin v molekule proteinů.
Rychlost glykace je ovlivňována především koncentrací glukózy a dobou jejího působení. Probíhá i u zdravých jedinců. Glykace se uskutečňuje na všech sérových proteinech a vede ke vzniku glykovaných derivátů. Glykovány jsou jak rozpustné, tak strukturní bílkoviny.
Neenzymová glykace probíhá v několika fázích tzv. Maillardovy reakce.
- Sled glykačních reakcí zahajuje aldehydová skupina redukujícího cukru, která se váže na aminoskupinu proteinu. Vzniká labilní aldimin typu Schiffovy báze (časné produkty glykace). Tvorba Schiffovy báze je rychlá, rovnováhy dosáhne během několika hodin. Tato reakce je reverzibilní.
- Schiffova báze pak pomalu, během několika dní, podléhá chemickému přesmyku. Vzniká stabilnější přechodný produkt glykace, tzv. Amadoriho produkt, který má charakter ketoaminu. Vzniká přitom ketoskupina na druhém uhlíku cukru, která je charakteristická pro fruktózu. Koncentraci vzniklých fruktózaminů můžeme stanovit reakcí s nitrotetrazoliovou modří (viz níže). Amadoriho produkty jsou rovněž do jisté míry reverzibilní, i když rovnováha je značně posunuta ve směru jejich tvorby. Ustáleného stavu je dosaženo za několik týdnů. Množství ketoaminů lze snížit normalizací glykémie.
- Ze Schiffovy báze se také může odštěpit aldóza, která je o dva uhlíky kratší než původní cukr navázaný na bílkovinu. Na bílkovině zůstává navázaný dvouuhlíkatý zbytek, který se dále oxiduje a reaguje s další aminoskupinou bílkoviny. Výsledkem řetězce dalších reakcí je tvorba vysoce reaktivních dialdehydů typu glyoxalu.
- Amadoriho produkty jsou reaktivní látky. Za týdny a měsíce nezávisle na přítomnosti glukózy vznikají z Amadoriho produktů reakcemi především s proteiny s dlouhou životností (např. kolagen, elastin, myelin nervů) pokročilé produkty glykace (advanced glycation end-products, AGE). Tyto procesy jsou ireverzibilní.
Neenzymová glykace při dlouhodobě trvající hyperglykémii je jednou z příčin poškození tkání některých orgánů u pacientů s diabetes mellitus.
Stanovení produktů glykace Amadoriho typu je vhodným ukazatelem dlouhodobé koncentrace glukózy a poskytuje nepřímou informaci o průběhu glykémií v časovém období, které odpovídá biologickému poločasu bílkoviny. Běžně se stanovuje glykovaný hemoglobin a glykované proteiny.
Stanovení glykovaného hemoglobinu a glykovaných proteinů se využívá pro kontrolu diabetes mellitus a pro diagnostiku trvalé hyperglykémie. Ze zvýšených hodnot glykovaných derivátů vyplývá, že v průběhu uplynulých týdnů převažovaly u pacienta zvýšené hodnoty glukózy v krvi a že diabetes mellitus nebyl dostatečně kompenzován.
Glykovaný hemoglobin
Glykovaný hemoglobin (HbA1c) je považován za nejlepší způsob dlouhodobé kontroly koncentrace glukózy u diabetiků. Koncentrace glykovaného hemoglobinu informuje o hodnotách glykémie v předchozích 2–3 měsících (doba životnosti erytrocytu). Stanovuje se chromatografickými nebo imunochemickými metodami.
Hodnocení koncentrace glykovaného hemoglobinu (HbA1c) u diabetiků Kompenzovaný DM ≤ 45 mmol/mol Potřeba změny terapie ≥ 53 až 70 mmol/mol
Hodnocení koncentrace glykovaného hemoglobinu v tabulce výše je orientační. Cílové koncentrace se liší podle rizikovosti hyper-/hypoglykémií u konkrétního pacienta.[12]
Stanovení glykovaného hemoglobinu lze také použít pro skrínink diabetu mellitu. Při koncentraci HbA1c nad 39 mmol/mol vyslovíme podezření na diabetes mellitus[13]. Je-li koncentrace HbA1c vyšší než 48 mmol/mol, můžeme diagnózu diabetu mellitu považovat za potvrzenou.[14]
Hodnocení koncentrace glykovaného hemoglobinu (HbA1c) při skríninku diabetu mellitu Fyziologické hodnoty < 39 mmol/mol Podezření na diabetes mellitus 39–48 mmol/mol Diabetes mellitus ≥ 48 mmol/mol
Fruktózaminy
Glykované proteiny neboli fruktózaminy mají kratší biologický poločas a jejich hladina odráží průměrnou hodnotu koncentrace glukózy za období 2–3 týdnů před vyšetřením. Jejich hlavní složkou je glykovaný albumin. Výsledky může falešně snížit hypoproteinemie. Stanovení koncentrace fruktózaminů dnes nepatří mezi rutinně prováděná vyšetření u diabetiků.
Hodnocení koncentrace glykovaných proteinů (S-glykované proteiny) Fyziologické hodnoty: 205–285 μmol/l Dobrá kompenzace DM: 285–320 μmol/l Uspokojivá kompenzace DM: 321–370 μmol/l Špatná kompenzace DM: nad 370 μmol/l
Princip stanovení glykovaných proteinů (fruktózaminu)
Vyšetření glykovaných proteinů využívá redukčních vlastností fruktózaminu v alkalickém prostředí. Fruktosamin se v přítomnosti uhličitanového pufru přeuspořádává na svůj tautomer – eneaminol, reaguje s nitrotetrazoliovou modří (NBT). Při redukci dochází k otevření heterocyklických kruhů NBT a vzniku barevného formazanu. Rychlost vzniku formazanu je přímo úměrná koncentraci fruktózaminu.
Jako každá metoda, využívající redukčních vlastností některých součástí séra, je toto vyšetření nespecifické. Zahajuje se proto několikaminutovou inkubací, která má odstranit vliv rychle reagujících redukujících látek. V komerčních soupravách je součástí činidla enzym urikáza, která eliminuje redukci NBT kyselinou močovou.
Glukóza v moči
Glukóza filtrovaná do primární moči z plazmy se aktivním transportem zpětně resorbuje v proximálních tubulech. Organismus si chrání glukózu před zbytečnými ztrátami, proto mají ledvinné tubuly značnou rezervní kapacitu – za fyziologických okolností je transportní systém vytížen jen asi z jedné třetiny. Při hyperglykémii využití transportního systému stoupá, a překročí-li glykémie hodnoty kolem 10 mmol/l (tzv. ledvinný práh pro glukózu), je kapacita tubulární resorpce překročena a glukóza přechází do moči. Ztráty glukózy močí větší než 0,72 mmol / 24 hodin označujeme jako glykosurii (glukosurii). Glykosurie je nejčastějším nálezem vedoucím k odhalení diabetes mellitus. Negativní nález glukózy v moči však toto onemocnění nevylučuje. Stanovení glukózy v moči proto nepatří mezi základní biochemické parametry používané pro diagnózu a sledování DM.
Nález glykosurie je nutno hodnotit společně s výší glykémie nalačno. Na základě glykémie rozlišujeme:
- Hyperglykemickou glykosurii, která je typickým nálezem při diabetes mellitus. Při déletrvajícím onemocnění se ale zvyšuje renální práh pro glukózu a glykosurie může dokonce vymizet. Proto jde pouze o orientační vyšetření, na jehož základě nelze řídit terapii DM. Přechodně se může vyskytnout i tzv. „alimentární glykosurie” jako důsledek stravy bohaté na sacharidy nebo v průběhu oGTT.
- Normoglykemická renální glykosurie, při níž koncentrace glukózy v krvi není zvýšená. Je důsledkem poruchy ledvinných tubulárních buněk, které zajišťují zpětnou resorpci glukózy. Může být projevem autosomálně recesivního onemocnění, častěji se vyskytuje např. při toxickém či zánětlivém poškození ledvin postihujícím funkci proximálního tubulu.
Metody stanovení glykosurie
Ke stanovení glykosurie lze použít nespecifické chemické reakce nebo testovací proužky.
Nespecifické chemické reakce jsou založené na redukčních vlastnostech monosacharidů. Fehlingova a Benedictova zkouška využívají nespecifické redukce chelátového komplexu CuII+ s citrátem nebo tartarátem na Cu1+. Při Nylanderově zkoušce se v přítomnosti redukujících látek redukuje dusičnan-oxid bismutitý BiNO3(O) na černý kovový bismut. Tyto reakce jsou pozitivní nejen pro glukózu, ale i další redukující sacharidy, popř. látky s redukčními vlastnostmi (např. kyselinu askorbovou). Vyšetřovaná moč nesmí obsahovat bílkoviny.
Stanovení glukózy v moči diagnostickým proužkem
Diagnostické proužky pro průkaz glukózy v moči jsou založeny na principu enzymových reakcí s glukózaoxidázou a peroxidázou (stejný princip jako stanovení glykémie). D-glukóza je pomocí glukózaoxidázy oxidována kyslíkem a vzniká D-glukono-1,5-lakton a peroxid vodíku. V následné peroxidázové reakci peroxid vodíku oxiduje tetrametylbenzidin či jiný chromogen na barevný produkt. Světle žluté zbarvení reakční plošky se při pozitivitě mění na modrozelené. Test je specifický pro D-glukózu, jiné cukry neposkytují pozitivní reakci.
Vysoké koncentrace redukujících látek jako je kyselina askorbová zpomalují vývin zbarvení a mohou vést k falešně nižším výsledkům. V těchto případech se doporučuje opakovat analýzu minimálně 10 hodin po vysazení vitaminu C. Naopak falešně pozitivní výsledky mohou být způsobeny přítomností peroxidu vodíku či oxidačních činidel (některé dezinfekční prostředky) v odběrové nádobě. Stanovení glukózy v moči je nutno provést rychle, aby se zamezilo kontaminaci bakteriemi, nebo moč uchovávat při 4 °C.
Interference s kyselinou askorbovou je častým zdrojem falešných negativit. Diagnostické proužky pro vyšetření moči od některých výrobců jsou proto upraveny tak, aby reakční zóna byla vůči kyselině askorbové alespoň do určité míry odolná. Některé diagnostické proužky také mají detekční zónu pro askorbát, která na možnost falešné negativity upozorní.
Pozitivní glykosurie je naléhavou indikací k vyšetření glykémie na lačno.
Ketolátky v moči
Termínem „ketolátky” rozumíme kyselinu acetoctovou, aceton a kyselinu β-hydroxymáselnou. Zvýšené vylučování ketolátek močí ukazuje na zvýšenou lipolýzu a zvýšenou tvorbu acetyl-CoA, který v důsledku nedostatečné utilizace glukózy při nedostatku inzulinu není metabolizován normálně v Krebsově cyklu. Výsledkem je hromadění acetyl-CoA, který kondenzuje na kyselinu acetoctovou. Větší část kyseliny acetoctové je v játrech redukována na kyselinu β-hydroxymáselnou, menší část spontánně dekarboxyluje na aceton[15].
Stanovení ketolátek v moči má význam především u diabetiků 1. typu. U správně léčeného diabetika ketolátky v moči nenacházíme. Jejich přítomnost svědčí pro metabolickou ketoacidózu a je provázena hyperglykemií. Malé množství ketolátek v moči se může objevit při redukci tělesné hmotnosti nebo při hladovění a v těhotenství. Ketonurie může svědčit i pro poruchu tubulárních funkcí, kdy je nedostatečná resorpce ketolátek.
Hlavním představitelem ketolátek v moči je kyselina β-hydroxymáselná, která tvoří asi 60–70 %, kyselina acetoctová je zastoupena asi 30–35 % a aceton se podílí pouze několika procenty.
Průkaz ketolátek je založen na reakcích kyseliny acetoctové a acetonu s nitroprusidem sodným v alkalickém prostředí, kdy vzniká červenofialově zbarvený komplex[16]. Tento princip využívá Legalova a Lestradetova zkouška, stejně tak jsou na něm postaveny i diagnostické proužky. Kyselina β-hydroxymáselná (tedy nejhojněji zastoupená ketolátka) reakci neposkytuje, a proto negativní výsledek ketoacidózu zcela nevylučuje[17].
Falešnou pozitivitu zkoušek na ketolátky v moči poskytují sloučeniny s volnými sulfhydrylovými skupinami (např. antihypertenzivum kaptopril či uroprotektivum užívané v některých chemoterapeutických schématech mesna)[16]. Poměrně často poskytují podobnou reakci také produkty bakterií při infekcích močových cest.
Falešné negativity kromě již uvedené necitlivosti zkoušek ke kyselině β-hydroxymáselné nejsou významné.
Další laboratorní vyšetření nemocných s diabetem
Inzulin (vzhledem ke způsobu stanovení též imunoreaktivní inzulin, IRI). Vzhledem k velkému kolísání hladin v průběhu dne, interferenci s případnými autoprotilátkami a nemožnosti rozlišit endogenní inzulin od inzulinu podaného léčebně se zpravidla stanovuje během zátěžových testů (oGTT). Hodnoty jsou snížené u diabetiků 1. typu, při syndromu inzulinové rezistence bývají naopak zvýšené.
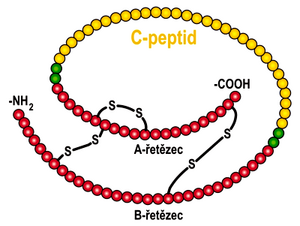
C-peptid C-peptide je část molekuly proinzulinu, která se odštěpuje před sekrecí inzulinu. Jeho koncentrace v séru odpovídá sekreci inzulinu. Není vychytáván játry a vzhledem k tomu, že v injekčně podávaném inzulinu C-peptid není, nejsou výsledky ovlivněny léčbou. Prochází glomerulární membránou, a proto se jeho koncentrace zvyšuje při renální insuficienci.
S diabetem 1. typu bývá také spojena pozitivita autoprotilátek proti Langerhansovým ostrůvkům (ICA), proti inzulinu (IAA) a zejména proti jedné izoformě glutamátdekarboxylázy (GAD 654).
Odkazy
Související články
- Glukóza v krvi
- Diabetes mellitus
- Diabetes mellitus 1. typu
- Diabetes mellitus 2. typu
- Gestační diabetes
- Hraniční poruchy glykoregulace
- Glykémie/stanovení
- Orální glukózový toleranční test
- Glykované proteiny
- Glukóza v moči
- Ketolátky v moči
- C-peptid
Reference
- ↑ Ústav zdravotnických informací a statistiky ČR. . Zdravotnická ročenka České republiky 2019 [online] . - vydání. 2020. 203 s. s. 37. Dostupné také z <https://www.uzis.cz/res/f/008381/zdrroccz2019.pdf>.
- ↑ ČEŠKA, Richard, et al. Interna. 3. vydání. Praha : Triton, 2020. 970 s. ISBN 978-80-7553-780-5.
- ↑ ČEŠKA, Richard, et al. Interna. 3. vydání. Praha : Triton, 2020. 970 s. ISBN 978-80-7553-780-5.
- ↑ NAIK, Ramachandra G, Barbara M BROOKS-WORRELL a Jerry P PALMER. Latent autoimmune diabetes in adults. J Clin Endocrinol Metab [online]. 2009, vol. 94, no. 12, s. 4635-44, dostupné také z <https://academic.oup.com/jcem/article/94/12/4635/2596267>. ISSN 0021-972X (print), 1945-7197.
- ↑ Česká gynekologická a porodnická společnost. Gestační diabetes mellitus. - [online]. 2019, roč. -, vol. -, s. -, dostupné také z <http://www.gynultrazvuk.cz/data/clanky/6/dokumenty/2019-05-gestastacni-diabetes-mellitus-dp-cgps-cls-jep-revize.pdf>.
- ↑ JOSEPH, Wang. Electrochemical glucose biosensors. Chemical reviews [online]. 2008, vol. 108, no. 2, s. 814-825, dostupné také z <https://pubs.acs.org/action/cookieAbsent>. ISSN 0009-2665.
- ↑ HELLER, Adam a Ben FELDMAN. Electrochemical glucose sensors and their applications in diabetes management. Chemical reviews [online]. 2008, vol. 108, no. 7, s. 2482-2505, dostupné také z <https://pubs.acs.org/action/cookieAbsent>. ISSN 0009-2665.
- ↑ Doporučený postup. Diabetes mellitus - laboratorní diagnostika a sledování stavu pacientů. 2015. Dostupné také z URL <http://www.cskb.cz/res/file/doporuceni/DM/DM_dop_201601.pdf>.
- ↑ Doporučený postup. Dooručené diagnostické a terapeutické postupy pro všeobecné praktické lékaře. 2020. Dostupné také z URL <https://www.svl.cz/files/files/Doporucene-postupy/2020/DIABETES-MELLITUS-2020.pdf>.
- ↑ Doporučený postup. Gestační diabetes mellitus. 2019. Dostupné také z URL <https://www.gynultrazvuk.cz/uploads/recommendedaction/31/doc/p-2019-05-gestacni-diabetes-mellitus-schema-dohromady.pdf>.
- ↑ Doporučené diagnostické a terapeutické postupy pro všeobecné praktické lékaře. Diabetes mellitus. 2019. s. 4. Dostupné také z URL <https://svl.cz/svl-docs/doporucene-postupy/19/diabetes-mellitus-lecba-u-starsich-pacientu-v-cr-2019.pdf>.
- ↑ KAREN, Igor a Štěpán SVAČINA. Diabetes mellitus : doporučené diagnostické a terapeutické postupy pro všeobecné praktické lékaře 2018. - vydání. Společnost všeobecného lékařství ČLS JEP, 2018. ISBN 9788086998992.
- ↑ Doporučený postup. Doporučený postup péče o diabetes mellitus 2. typu. 2016. Dostupné také z URL <http://www.diab.cz/dokumenty/doporuceni_DM_2015-2.pdf>.
- ↑ Doporučený postup. Diabetes mellitus - laboratorní diagnostika a sledování stavu pacientů. 2015. Dostupné také z URL <http://www.cskb.cz/res/file/doporuceni/DM/DM_dop_201601.pdf>.
- ↑ MURRAY, Robert K, Daryl K GRANNER a Victor W RODWELL. Harper's Illustrated Biochemistry. 27. vydání. New York : Lange Medical Books/McGraw-Hill, 2006. 692 s. a Lange medical book; s. 190-194. ISBN 978-0-07-125300-0.
- ↑ a b HOHENBERGER, E.F. a H KIMLING. Compendium urinanalysis. Urinanalysis with test strip [online] . 1. vydání. Mannheim : Roche Diagnostics, 2008. 105 s. Dostupné také z <http://www.diavant.info/diavant/servlet/MDBOutput?fileId=1392>.
- ↑ PLIVA-Lachema Diagnostika. PHAN® diagnostické proužky k vyšetření moče [online]. Poslední revize 2009-12-04, [cit. 2010-03-21]. <https://www.erbalachema.com/cz/>.