Cystická fibróza
| cystická fibróza | |
 Klinická manifestace cystické fibrózy | |
| Příčina | defekt chloridového kanálu, mutace v CFTR genu (AR dědičnost) |
|---|---|
| Diagnostika | klinické podezření, stanovení koncentrace chloridů v potu, molekulárně-genetické vyšetření |
| Vyšetření v ČR | seznam pracovišť |
| Incidence ve světě | 1/8 000 – 1/10 000 (Evropa) [1] |
| Klasifikace a odkazy | |
| MKN-10 | E84 |
| MeSH ID | D003550 |
| OMIM | 219700 |
| orphanet | ORPHA586 |
| MedlinePlus | 000107 |
| Medscape | 1001602 |
Cystická fibróza neboli mukoviscidóza je multisystémové autozomálně recesivní geneticky podmíněné onemocnění, které se v klasické formě projevuje chronickým progredujícím onemocněním dýchacích cest a plic, insuficiencí zevní sekrece pankreatu, vysokou koncentrací elektrolytů v potu a poruchou reprodukce mužů.
Výskyt a dědičnost[upravit | editovat zdroj]
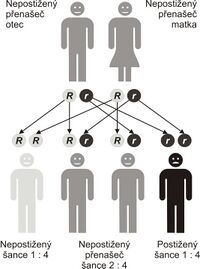
Cystická fibróza je nejčastější život ohrožující dědičné onemocnění europoidní populace (bílé rasy). Výskyt v ČR je odhadován na 1:2 500, ročně se tedy narodí 35–45 dětí s CF (všechny případy ale nejsou diagnostikovány).
Jedná se o autosomálně recesivně (AR) dědičné onemocnění. Defektní gen CFTR (cystic fibrosis transmembrane conductance regulator) se nachází na dlouhém raménku 7. chromosomu . Tento gen kóduje chloridový kanál. Je známo asi 2015[2] mutací tohoto genu (v 68 % je mutace ΔF508).
Patogeneze[upravit | editovat zdroj]
Příčinou onemocnění je porucha transportu iontů apikální membránou buněk (chloridový kanál regulovaný pomocí cAMP). Následkem mutace CFTR genu je v potu velká koncentrace chloridů a sodíku. V dýchacích cestách, GIT a reprodukčním systému vede zvýšená koncentrace chloridových aniontů k excesivní reabsorbci sodíku. Sodík je pasivně následován vodou a tím dochází k dehydrataci hlenu a tedy ke zvýšení jeho viskozity. Zahuštěním hlenu lze zjednodušeně vysvětlit většinu klinických projevů CF. Periciliární tekutina má být normálně hypotonická, u CF je izotonická, což porušuje schopnost baktericidie a působení antimikrobiálních peptidů (defenzinů). Tímto se vysvětluje iniciální bakteriální kolonizace. Infekce stimuluje buňky k další tvorbě hlenu, a tím zhoršuje obstrukci dýchacích cest.
Další roli hrají mastné kyseliny – v těle je nepoměr mezi kys. arachidonovou (je jí více) a dokosahexanovou. Toto hraje roli hlavně v regulaci zánětu.
Klinický obraz[upravit | editovat zdroj]
Klinický obraz závisí na věku, ve kterém se objeví první příznaky:
- U novorozenců je typický mekoniový ileus, protrahovaný
ikterus a fakt, že do 1 měsíce nedosáhnou své porodní hmotnosti. Dále také hypoproteinémie s
edémy a metabolický rozvrat – metabolická alkalóza.
- U kojenců je charakteristické
neprospívání při velké chuti k jídlu,
steatorea, která budí dojem intolerance kravského mléka nebo céliakie a prolaps rekta.
- Větší děti mívají
poruchu růstu, opakované sinusitidy (často chybně léčeny na astma) a
paličkovité prsty.
- V dospělém věku se objevuje azoospermie, která může být u některých mutací i jediným příznakem. Mezi nejčastější respirační obtíže patří chronický kašel,
tachypnoe,
hemoptýza, bronchiektázie, nosní polypy a hvízdání.
Respirační projevy[upravit | editovat zdroj]
se mohou manifestovat v každém období života. U kojenců to bývá kritické, s těžce probíhající bronchiolitidou. Vyskytuje se i atelektáza a pneumonie. V pozdějším věku je nejčastějším projevem kašel (suchý, dráždivý nebo produktivní, spojený s hnisavou expektorací). Je dán exacerbacemi plicních infekcí. Malé děti sputum polykají a zvracejí. Někteří kašlou stále, jiní mají období bez kašle. Jen vzácně provází exacerbace zvýšená teplota. Citlivý ukazatel horšícího se poškození dýchacích cest je tachypnoe.
Původci infekce dýchacích cest jsou nejčastěji S. aureus, Hemofilus, Pseudomonas event. Burkholderia (velmi rezistentní k ATB). Pseudomonas se běžně vyskytuje v zevním prostředí a pacienty osidluje hlavně její mukózní forma. Prevalence pseudomonádových infekcí stoupá s věkem. Často se přenášejí z jednoho CF pacienta na druhého, a proto se doporučuje striktní separace nemocných s CF. Pro zdravé jedince není pseudomonáda nebezpečná. Některé kmeny Burkholderia cepacia vyvolávají tzv. cepacia syndrom (septický s disperzní pneumonií), který vede rychle k úmrtí na abscedující pneumonii a sepsi. Vzácné nejsou ani mykotické komplikace (Aspergillus). Tyto infekce vyvolávají závažné chronické změny – trvalé poškození kapilár i stěny dýchacích cest.
Chronickou bronchitidu komplikují bronchiektázie, atelektázy a emfyzém či chronická pansinusitida, často provázena nosní polypózou. Časně se vyvíjejí paličkovité prsty.
Mezi závažné respirační komplikace CF patří pneumotorax, hemoptýza, globální respirační insuficience. Parciální dechová nedostatečnost je jinak celkem častá, vede k plicní hypertenzi a vývoji cor pulmonale. Rozvoj globální insuficience s hyperkapnií je varovným znamením.
Postižení GIT[upravit | editovat zdroj]
se manifestuje hlavně neprospíváním a to následně nepříznivě ovlivňuje průběh respiračních infekcí. Hlavní příčinou je insuficience zevní sekrece pankreatu, tedy že potrava není dostatečně štěpena. Děti mají balónovitě vzedmuté bříško, které kontrastuje s hůlkovitými končetinami. Stolice jsou objemné, mastně a nápadně páchnou. Děti mají dobrou chuť k jídlu, ale nepřibývají (neúměrně tomu, co snědí). Nejčastěji to vzniká při přechodu na umělou výživu, ale pankreatická insuficience nemusí být přítomna a projeví se později nebo při velké chuti k jídlu může být neprospívání kompenzováno.
Dále jsou deficity vitaminů A, D, E, K, minerálů a stopových prvků.
Prolaps rekta může někdy být prvním projevem choroby. Později je přítomen hlavně u dětí se špatnou léčbou nebo při úporném kašli. Časté bolesti břicha mohou mít mnoho příčin, jako například roztažení kliček obsahem, plynatostí, svalové bolesti od úporného kašle atp. Syndrom distální intestinální obstrukce, tedy ucpání střeva zahuštěným obsahem, tzv. ekvivalent mekoniového ileu může probíhat jako NPB, na níž se podílí dehydratace aj. Asi 10–15 % pacientů s CF se rodí s mekoniovým ileem (střevní neprůchodnost v prvních hodinách života).
Hepatobiliární komplikace[upravit | editovat zdroj]
se projevují různě závažně. Jsou způsobené obstrukcí žlučových kanálků. Mohou vyústit v cirhózu a portální hypertenzi. Někdy se manifestuje jako cholestatická žloutenka, častá je cholelitiáza a GER. Recidivující pankreatitida se popisuje zejména u pacientů bez defektu sekrece.
Sekrece slin[upravit | editovat zdroj]
Chloridový kanál kódovaný CFTR genem kromě Cl– iontů může skrze sebe propouštět i HCO3– ionty. Tohoto se využívá při sekreci slin, kdy buňky vývodů slinných žláz (duktální buňky) obsahují na svém apikálním povrchu právě CFTR kanály a využívají je pro sekreci bikarbonátu do slin. Důsledkem této sekrece je vyšší pH slin (až 8), díky kterému mají sliny antibakteriální účinky. Pri cystické fibróze však tento kanál není funkční ani zde, a tak jsou sliny méně alkalické a nemohou tak dostatečně plnit svou antimikrobiální funkci.[3]
Další projevy[upravit | editovat zdroj]
- Diabetes mellitus spojený s CF je asi v 10 %.
- Dilatační kardiomyopatie.
- Chronické infekce, které se pokládají za příčinu vzniku mnoha autoimunitních procesů.
- Osteoporóza, která je přítomna téměř u čtvrtiny dospělých nemocných.
- 98 % mužů je neplodných pro obstrukci vas deferens (obstruktivní azoospermie).
Diagnóza a diferenciální diagnóza[upravit | editovat zdroj]
Diagnóza se opírá o:
- klinické podezření,
- stanovení koncentrace chloridů v potu,
- molekulárně-genetické vyšetření.
Klinické podezření vzniká na základě přítomnosti hlavních příznaků CF, které musí vzbudit podezření:
- chronický sinopulmonální syndrom,
- paličkovité prsty,
- průkaz pseudomonády,
- typický obraz rtg,
- trávicí problémy,
- CF v rodinné anamnéze,
- průkaz azoospermie.
Principem potního testu je stimulace pocení pilokarpinovou iontoforézou, sběr potu a kvantitativní stanovení chloridů. Normální hodnoty chloridů v potu jsou 10–30 mmol/l, u CF jsou hodnoty nad 60 mmol/l. Při pilokarpinové iontoforéze se využívá stejnosměrného proudu o intenzitě 4 mA. Pomocí tohoto proudu pronikne pilokarpin (parasympatomimetikum) kůží k potním žlázám, kde stimuluje pocení. Pot se získává po ukončení iontoforézy v místě pozitivní elektrody (anody).[4] U všech nemocných s pozitivním testem je třeba udělat analýzu genotypu.
Genetické vyšetření se provádí nejčastěji z leukocytů z žilní krve u dětí a dospělých osob, případně z buněk plodové vody či choriových buněk v rámci prenatální diagnostiky. Je nezbytné pro potvrzení diagnózy, umožní odkrýt nosiče v rizikové rodině, na základě čehož jim je možné nabídnout cílenou prenatální diagnostiku.
Vyšetření funkce pankreatu není nezbytné pro diagnostiku CF, ale je potřeba pro rozhodnutí o substituční léčbě. Používá se kvantitativní vyšetření ztrát tuků stolicí. Vyšetření stolice na přítomnost elastázy pomocí ELISA.
Sledování stavu výživy – výška, hmotnost, poměr hmotnosti k výšce a obvod paže (v percentilech).
Mikrobiologie sekretu dýchacích cest by měla být provedena při každé kontrole, abychom včas odhalili infekci.
Rtg plic je charakteristický, dělá se při podezření na infekční komplikaci a pravidelně jednou ročně. Bronchovaskulární kresba je zmnožená, hily zvětšené. Hnisem naplněné bronchiektázie a emfyzematózní buly ukazují na závažné poškození. Významné jsou známky emfyzému (především na bočním snímku) vyskytující se zejména retrosternálně a retrokardiálně. Pro lepší diagnostiku bronchiektázií lze využít HRCT.
Vyšetření funkce plic – časný projev je obstrukce periferních dýchacích cest, později narůstá hyperinflace a obstrukce centrálních cest.
Dále pravidelně provádíme vyšetření krevních plynů pro včasné odhalení respirační insuficience. Orientačně se osvědčuje i pulzní oxymetrie (při poklesu saturace pod 92 % indikujeme Astrupa).
Jinak se pravidelně sledují zánětlivé markery, 2× ročně jaterní testy, jednou ročně EKG, hladina vitaminů A a E. U dětí nad 10 let vyšetřujeme glukózovou toleranci oGTT, kostní věk a USG jater.
Diferenciálně diagnosticky zvažujeme recidivující záněty dýchacích cest, sinobronchiální syndrom, event. asthma bronchiale. Při gastrointestinálních projevech céliakii.
Od října roku 2009 je v ČR test na cystickou fibrózu součástí novorozeneckého screeningu.
Terapie[upravit | editovat zdroj]
Léčba musí být intenzivní a komplexní, dítě musí být dispenzarizováno (ideálně jednou měsíčně, min. čtvrtletně).
Léčba respiračních projevů spočívá hlavně v boji s infekcí a péči o průchodnost dýchacích cest. Důležitá je prevence, jako například očkování, zvláště proti chřipce, a podpora vykašlávání např. pomocí "Flutteru", což je „kulička“, která při výdechu vibruje a tím zlepšuje pohyb hlenu v bronchu.
Při exacerbaci respiračního infektu zahajujeme cílenou, intenzivní antibiotickou terapii. K docílení terapeutické koncentrace v séru potřebuje CF pacient větší dávky. Při prvním záchytu pseudomonády nasazujeme per os ciprofloxacin (30 mg/kg/den) a inhalačně kolistin. Fluorochinolony se užívají v pediatrii jen výjimečně, protože poškozují růstové chrupavky. Jsou indikovány pouze u CF a z vitální indikace. U dětí chronicky infikovaných pseudomonádou dáváme 3–4× ročně po dobu 14 dní i. v. ATB bez ohledu na klinický stav (kombinace – aminoglykosid + betalaktam, příp. kotrimoxazol). Zásadně se vyhýbáme monoterapii, protože ta často vede k rezistenci.
Protizánětlivá léčba spočívá hlavně v podávání NSA (kortikoidy jsou účinné, ale mají mnoho NÚ). Podává se ibuprofen v dávce 20–30 mg/kg 2× denně.
Průchodnost dýchacích cest, tedy zřeďování sekretu, se zajišťuje pomocí inhalace mukolytik (N-acetylcystein, bromhexin, ambroxol). Hnisavý sekret velmi dobře rozpouští rekombinantní lidská deoxyribonukleáza (rozpouští DNA z rozpadlých PMN), podávaná inhalačně.
Bronchodilatancia se uplatňují méně než u jiných chronických obstrukčních nemocí, protože někdy mohou vyvolat kolaps bronchů. Indikují se výhradně nemocným s pozitivním bronchodilatačním testem.
U pacientů s trvalou hyposaturací se využívá domácí kyslíková léčba.
Transplantace plic je krajním řešením u pacientů, kteří nemají naději, že budou žít víc jak 2 roky. Indikována je při nemožnosti ovlivnit průběh klasickou léčbou, poklesu FEV1 pod 30 a na přání nemocného. Většinou se provádí bilaterální sekvenční transplantace plic od kadaverózních dárců. Začíná se transplantovat plicní laloky od žijících příbuzných (2 dárci – vždy půl plíce od každého). 70–80 % přežívá první rok po transplantaci, 50–55 % přežívá 5 let. Většině pacientů se po transplantaci výrazně zlepší kvalita života.
Důležitá je péče o dobrý stav výživy, a to jíž od prvních dnů stanovení diagnózy. Nemocný potřebuje o cca 40 % více energie (z toho 35–45 % mají hradit tuky, hlavně rostlinné). Důraz je kladen na vydatné snídaně a svačiny, druhé večeře, dostatečný přívod tekutin a solí. Pokud se stav neupravuje perorálně, volíme nazogastrickou sondu nebo perkutánní gastrostomii. Podáváme vitaminy rozpustné v tucích (vitamin K – do jednoho roku věku podáváme 2–5 mg týdně). Pankreatická substituce v podobě mikrotablet obalených acidorezistentní vrstvou, které se rozpouštějí až v distálním duodenu – obsahují různé koncentrace pankreatických enzymů (hlavně lipázu). Léky podáváme před každým jídlem (s výjimkou ovoce).
Prognóza se v posledních desetiletích výrazně zlepšila. Délku přežití určuje rychlost progrese plicního postižení. Dnes narození mají naději přežít 40 let.
V poslední době je velmi významná léčba pomocí CFTR modulátoru (Ivakaftor, lumakaftor).
Zajímavost[upravit | editovat zdroj]
Relativně vysoký výskyt mutací G551D a CFTRdel21kb genu CFTR u pacientů s cystickou fibrózou v České republice může souviset se zastoupením potomků slovanského respektive keltského etnika v současné české populaci.[5] [6] Mezi lingvisty a historiky, kteří nenacházejí oporu pro takovou interpretaci genetických výzkumů ve svých disciplínách, vládne vůči výše popsaným interpretacím spíše skepse.[7]
Odkazy[upravit | editovat zdroj]
Použitá literatura[upravit | editovat zdroj]
- DÍTĚ, P., et al. Vnitřní lékařství. 2. vydání. Praha : Galén, 2007. ISBN 978-80-7262-496-6.
Zdroje[upravit | editovat zdroj]
- BENEŠ, Jiří. Studijní materiály [online]. [cit. 2009]. <http://jirben.wz.cz>.
Reference[upravit | editovat zdroj]
- ↑ ORPHANET,. Cystic fibrosis [online]. [cit. 2015-12-08]. <https://www.orpha.net/consor/cgi-bin/Disease_Search.php?lng=EN&data_id=49&Disease_Disease_Search_diseaseGroup=cystic-fibrosis&Disease_Disease_Search_diseaseType=Pat&Disease(s)/group%20of%20diseases=Cystic-fibrosis&title=Cystic-fibrosis&search=Disease_Search_Simple>.
- ↑ http://genet.sickkids.on.ca/cftr/StatisticsPage.html
- ↑ prof. HAMPL Trávení, sekrece a abropce https://youtu.be/RcxrMK1cZsE?t=1572
- ↑ [1]
- ↑ MACEK, Milan, Milan jr MACEK a Alice KREBSOVÁ, et al. Relativně vysoký výskyt mutací G551D a CFTRdel21kb CFTR genu v České republice u pacientů s cystickou fibrózou objektivně prokazuje, že naše populace je slovanského a keltského původu [online]. [cit. 2011-02-05]. <http://www.lf2.cuni.cz/Ustavy/ublg/pdf/kelticz99.pdf>.
- ↑ MACEK, Milan jr, et al. Population study of the CFTR gene mutations in Bohemia and Moravia: hypothesis on the historical spread of the G551D and F508 mutations in Europe. American Journal of Human Genetics. 1991, roč. 49, vol. Suppl. A 2703, s. -, ISSN 0002-9297.
- ↑ VENCLOVÁ, Natalie a Petr DRDA, et al. Archeologie pravěkých Čech : 7, Doba laténská. 1. vydání. Praha : Archeologický ústav AV ČR, 2008. 164 s. ISBN 978-80-86124-80-3.
