Novorozenecký screening
Mezi screeningová vyšetření u novorozenců patří:
- screening vrozené syfilis z pupečníkové krve (povinný);
- screening vrozené katarakty - vybavením červeného reflexu v zornici pomocí oftalmoskopu (povinné od roku 2005);
- screening vrozené hluchoty - vyšetření sluchu metodou tranzientně evokovaných otoakustických emisí (povinný od roku 2012);
- novorozenecký laboratorní screening z krve odebrané z patičky;
- od roku 2022 je nově doporučený screening spinální muskulární atrofie (SMA) a skupiny onemocnění těžké kombinované imunodeficience (SCID)
- od 1. 1. 2024 jsou screeningy zahrnuty do běžného novorozeneckého screeningu, zpočátku se jednalo o pilotní projekty.
- od roku 2022 je nově doporučený screening spinální muskulární atrofie (SMA) a skupiny onemocnění těžké kombinované imunodeficience (SCID)
- screening vývojové dysplázie kyčelního kloubu - vyšetření kyčlí ortopedem;
- vyšetření vrozených kritických srdečních vad pomocí pulzní oxymetrie - porovnání SpO2 na pravé horní končetině a dolních končetinách (nepovinný);
- ultrasonografické vyšetření ledvin (nepovinný).
V užším smyslu slova se pak novorozeneckým screeningem rozumí novorozenecký laboratorní screening.
Screening = systematické cílené vyhledávání určité choroby před její klinickou manifestací se snahou předejít včas jejím možným následkům[1]
- podle zvolené populace, v níž je porucha vyhledávána, rozlišujeme screening celoplošný (např. novorozenecký screening) a selektivní (v rizikové populaci)
- podmínky zavedení celoplošného screeningu:
- vyhledávaná porucha je klinicky diagnostikovatelná až v době, kdy již došlo k nevratnému poškození ohroženého systému, nebo bez jejího časného stanovení může být bezprostředně ohrožen život nositele poruchy,
- porucha má v populaci dostatečnou incidenci,
- je k dispozici efektivní léčba,
- existuje screeningový test s vysokou senzitivitou a dostatečnou specificitou,
- test je přiměřeně levný (příznivý poměr cost/benefit)[2].
Novorozenecký laboratorní screening[upravit | editovat zdroj]
U všech novorozenců narozených na území ČR se provádí novorozenecký laboratorní screening (NLS) 18 vrozených či dědičných onemocnění níže uvedených metodou odběru tzv. suché kapky krve na novorozenecké screeningové kartičce mezi 48. a 72. hodinou života. Cílem novorozeneckého screeningu je rychlá diagnostika a včasná léčba novorozenců s těmito onemocněními.
- hyperfenylalaninemie a fenylketonurie;
- metoda: tandemová hmotnostní spektrometrie;
- kongenitální hypotyreóza;
- metoda: stanovení tyroideu stimulujícího hormonu (TSH) fluoroimunoanalýzou (FIA);
- kongenitální adrenální hyperplazie;
- metoda: stanovení 17alfa-OH-progesteronu pomocí imunoanalytických metod;
- cystická fibróza;
- metoda: stanovení hladiny imunoreaktivního trypsinogenu (IRT) imunoanalytickou metodou;
- vybrané dědičné metabolické poruchy:
- metoda: tandemová hmotnostní spektrometrie;
- spinální muskulární atrofie a těžká kombinovaná imunodeficience (dobrovolný);
- metoda: kvantitativní polymerázové řetězové reakce v reálném čase (QRT-PCR).
Metodika odběru suché kapky krve na screeningovou kartičku[upravit | editovat zdroj]
- dobře omytá, prokrvená kůže na vnitřním či zevním okraji patičky novorozence se očistí alkoholem a nechá uschnout,
- provede se drobná incize do hloubky max. 2 mm sterilním kopíčkem ručně či lancetou (speciální automatické zařízení určené pro tento účel),
- první kapka krve se setře suchým sterilním tamponem,
- po vytvoření dostatečně velké další kapky se jemně přiloží filtrační papírek screeningové kartičky, tak aby se krev nasávala a úplně zaplnila předtištěný terčík a filtrační papír byl viditelně nasáklý z obou stran,
- patička se nesmí mačkat či ždímat, aby nedošlo k příměsi tkáňového moku,
- terčík musí být nasáknut najednou z jedné kapky, nesmí se vrstvit kapky do jednoho terčíku,
- je zapotřebí krví nasáknout všechny terčíky na novorozenecké screeningové kartičce,
- filtračního papírku se nikdy nedotýkáme a je nutno zabránit i kontaktu krevních kapek s jakýmkoliv předmětem,
- po odběru necháme krev zaschnout v horizontální poloze kartičky po dobu nejméně 3 hodin při pokojové teplotě (nejlépe ve speciálním stojánku na sušení kartiček),
- po zaschnutí krve se kapky překryjí krycím papírkem, který je součástí kartičky.[3]
Screening hyperfenylalaninémií a fenylketonurie[upravit | editovat zdroj]
- v ČR se provádí od roku 1975, incidence podle výsledků NLS (2010-2016) asi 1:5500[4]
- hyperfenylalaninémie (HPA) = porucha metabolismu fenylalaninu, při které dochází k jeho patologickému nahromadění v krvi a ostatních tělesných tekutinách → hyperfenylalaninémie poškozuje CNS – postihuje duševní vývoj dítěte a vede k těžké oligofrenii,
- nejtěžší forma: fenylketonurie (PKU) – incidence v ČR 1:10 000 živě narozených[2],
- v 97 % je příčinou deficit enzymu fenylalaninhydroxylázy,
- v 1–3 % je příčinou deficit tetrahydrobiopterinu,
- nejtěžší forma: fenylketonurie (PKU) – incidence v ČR 1:10 000 živě narozených[2],
- léčbu (eliminační dietu) je třeba zahájit nejpozději do 21 dnů,
- screening: metoda tandemové hmotnostní spektrometrie (od 1. 10. 2009)[3],
- odběr suché krevní kapky z patičky novorozence se provádí teprve 3.–4. den života, kdy dítě přijímá mléčnou stravu (aby byla hladina fenylalaninu dostatečně vysoká),
- v bílkovině mateřského mléka je fenylalanin zastoupen přibližně 5 %[2],
- kritéria pro diagnózu klasické fenylketonurie:,
- hladina fenylalaninu nad 20 mg/dl (nad 1,2 mmol/l),
- normální nebo snížená hladina tyrozinu,
- přítomnost abnormálních metabolitů v moči (kyselina fenylpyrohroznová),
- normální koncentrace tetrahydrobiopterinu, kofaktoru hydroxylace fenylalaninu na tyrozin.[5]
Screening kongenitální hypotyreózy[upravit | editovat zdroj]
- v ČR se provádí od roku 1985, incidence v ČR podle NLS: asi 1:3000 živě narozených novorozenců,[4]
- kongenitální hypotyreóza (CH) – nedostatek hormonů štítné žlázy u dětí vede k narušení vývoje mozku s následným ireverzibilním mentálním defektem různého stupně. Klinické příznaky se objevují pozdě (až při nevratném postižení CNS).
- vzniká na podkladě dysgeneze štítné žlázy (ageneze, hypoplazie, ektopie) nebo dyshormonogeneze (nejč. následkem deficitu tyroidální peroxidázy); hypofyzární a hypotalamické formy jsou vzácné,
- substituční léčbu L-tyroxinem je třeba zahájit do 14 dnů života,
- screening: stanovení tyroideu stimulujícího hormonu (TSH) fluoroimunoanalýzou (FIA)[5],
- u všech novorozenců s potvrzenou kongenitální hypotyreózou je třeba nejpozději do 3 měsíců po narození provést elektronický screening vrozených vad sluchu metodou tranzientních otoakustických emisí[3].
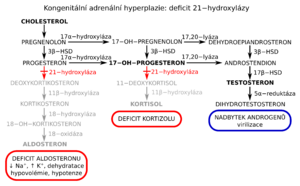
Screening kongenitální adrenální hyperplazie[upravit | editovat zdroj]
- v ČR se provádí od roku 2006, incidence CAH je cca 1:8000[5], podle výsledků NLS asi 1:13 000[4],
- kongenitální adrenální hyperplázie (CAH) = vrozená porucha syntézy steroidních hormonů, jejíž příčinou je chybění některého z pěti nezbytných enzymů (nejč. jde o deficit 21-hydroxylázy a dochází k hromadění 17alfa-OH-progesteronu. Následkem je zvýšená tvorba adrenálních androgenů → virilizace ženského zevního genitálu, předčasná pseudopuberta (pseudopubertas praecox), malý vzrůst,
- u 60 % postižených je současně přítomen i defekt tvorby mineralokortikoidů,
- substituční léčba hydrokortizonem (a mineralokortikoidy),
- screening: stanovení 17alfa-OH-progesteronu pomocí imunoanalytických metod[5].
Screening cystické fibrózy[upravit | editovat zdroj]
- v ČR se provádí od 1. 10. 2009[3], incidence dle NLS 1:6500[4]
- cystická fibróza (CF) = AR dědičné onemocnění, při kterém dochází k mutacím v genu kódujícím chloridový transportér na buněčné membráně,
- screening:
- vyšetření hladiny imunoreaktivního trypsinogenu (IRT) imunoanalytickou metodou,
- při podezření na CF (vysoké IRT) je druhým krokem molekulárně genetická analýza nejčastějších, jednoznačně patogenních a populačně významných mutací v genu CFTR ze stejných suchých kapek krve na screeningové kartičce, ve kterých byla zjištěna zvýšená koncentrace IRT,
- při velmi vysokém IRT a neprokázání mutace je třetím krokem provedení potního testu pomocí pilokarpinové iontoforézy[3].
Screening dalších dědičných metabolických poruch (DMP)[upravit | editovat zdroj]
- screening: metoda tandemové hmotnostní spektrometrie.
Dědičné poruchy metabolismu aminokyselin[upravit | editovat zdroj]
- Organické acidurie (v NLS od roku 2009)
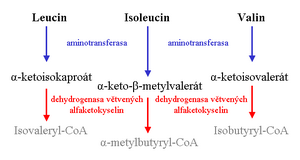
- leucinóza (nemoc javorového sirupu, MSUD), incidence 1 : 185 000 narozených;
- porucha metabolismu větvených aminokyselin (leucin, izoleucin a valin) → hromadění toxických metabolitů;
- klinický obraz u novorozenců: nesnášenlivost potravy, neprospívání, zvracení, letargie a zápachem moči a ušního mazu po javorovém sirupu či karamelu;
- bez léčby progreduje do ireverzibilní mentální retardace, hyperaktivity, neprospívání, záchvatového onemocnění, kómatu, mozkového edému a může vést k úmrtí.
- glutarová acidurie typ I (GA I), incidence 1 : 40 000;
- deficit glutaryl-CoA dehydrogenázy, která přeměňuje glutaryl-CoA na krotonyl-CoA → zvýšení hladiny toxické kyseliny glutarové a jejich metabolitů;
- klinický obraz u novorozenců: makrocefalie, ale jinak asymptomatičtí;
- pozdější symptomy: metabolická acidóza, neprospívání a náhlý nástup dystonie a athetózy z důvodu nevratného poškození striata.
- izovalerová acidurie (IVA), incidence 1 : 230 000;
- porucha metabolismu leucinu – porucha isovaleryl-CoA dehydrogenázy → hromadí se specifické metabolity, které mohou být toxické;
- klinický obraz u novorozenců: metabolická ketoacidóza, zápach „zpocených nohou“, dehydratace, hyperamonemie, ketonurie, zvracení, hypoglykémie a neprospívání; existují i mírnější formy bez projevů v novorozeneckém období.
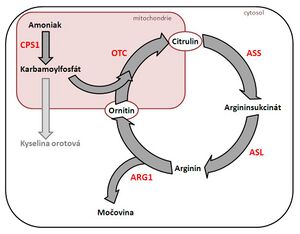
- Poruchy cyklu močoviny (v NLS od roku 2016)
- argininémie (ARG), incidence 1 : 300 000 narozených;
- deficit arginázy → hromadění argininu a amoniaku → dráždivost, porucha příjmu potravy, zvracení, neprospívání, neurologické příznaky (neobratnost, chůze po špičkách kolem věku 2-3 let, opoždění psychomotorického vývoje, křeče,…);
- ataky hyperamonémie při zvýšeném odbourávání aminokyselin (horečka, hladovění, infekty, operace) → amoniak je ve vysokých koncentracích toxický pro mozkové buňky → zmatenost, porucha vědomí, zvracení; život ohrožující.
- citrulinémie I. typu (CIT), v ČR dosud diagnostikováni 2 pacienti;
- deficit argininosukcinátsyntázy → hromadění citrulinu a amoniaku;
- těžká novorozenecká forma – velmi rychlá progrese s vysokou mortalitou;
- pozdní forma – manifestace v situacích zvýšených energetických nároků.
- Poruchy metabolismu sirných aminokyselin (v NLS od roku 2016)
- homocystinurie z deficitu cystathionin beta-syntázy (CBS), pyridoxin non-responzivní forma, incidence 1 : 6000 - 1 : 20 000;
- nejčastější porucha metabolismu sirných aminokyselin, blok v transsulfuraci homocysteinu;
- deficit cystathionin beta-syntázy → snížená kondenzace homocysteinu se serinem na cystathionin → hromadí se homocystein a jeho deriváty;
- kofaktorem enzymu je pyridoxal-5-fosfát, který vzniká z vitamínu B6 (pyridoxin) přijímaného ve stravě;
- mírný deficit: asymptomatický;
- těžký deficit: multisystémové postižení očí, kostry, centrálního nervového systému a cév;
- léčba pyridoxinem (část pacientů je non-responzivní), dietu s omezením methioninu/bílkovin ve stravě doplněnou s cysteinem obohaceným preparátem esenciálních aminokyselin a/nebo betainem.
- homocystinurie z deficitu methylentetrahydrofolátreduktázy (MTHFR), incidence není známá;
- onemocnění z poruchy metabolismu folátů a sirných aminokyselin, nejčastější porucha v remethylaci homocysteinu,
- těžký deficit methylentetrahydrofolátreduktázy → nedochází k redukci 5,10-methylentetrahydrofolátu na 5-methyltetrahydrofolát → hromadí se homocystein a jeho deriváty;
- klinický obraz těžkého deficitu: neurologické příznaky (opoždění psychomotorického vývoje, hypotonie a křeče), později psychiatrické problémy, neuropatie a trombembolické příhody;
- léčba: podávání vysokých dávek betainu.[6]
Dědičné poruchy metabolismu mastných kyselin[upravit | editovat zdroj]
- Poruchy beta-oxidace (v NLS od roku 2009)
- deficit acyl-CoA dehydrogenázy mastných kyselin se středně dlouhým řetězcem (deficit MCAD), incidence 1 : 20 000 narozených;
- porucha beta-oxidace středně dlouhých mastných kyselin → hromadění mastných kyselin a jejich potenciálně toxických derivátů;
- manifestace při hladovění a/nebo období zvýšených energetických nároků (horečka, stres), kdy produkce energie je z větší části závislá na metabolismu tuků;
- klinický obraz u novorozenců: asymptomatický, event. hypoglykémie, metabolická acidóza, hyperamonemie a hepatomegalie, bez léčby je vysoká mortalita, s léčbou a prevencí hypoglykemií je prognóza velmi dobrá.
- deficit 3-hydroxyacyl-CoA dehydrogenázy mastných kyselin s dlouhým řetězcem (deficit LCHAD), incidence 1 : 60 000 narozených;
- klinický obraz u novorozenců: ataky Reye-like syndromu s kardiomyopatií a/nebo myopatií (rhabdomyolýza), hepatomegalie, hepatopatie, hypoketotická hypoglykémie, laktátová acidóza a neprospívání; i u dobře léčených pacientů je klinická prognóza nejistá.
- deficit acyl-CoA dehydrogenázy mastných kyselin s velmi dlouhým řetězcem (deficit VLCAD), incidence 1 : 300 000 narozených;
- klinický obraz u novorozenců s kritickým deficitem: kardiomyopatie, arytmie, hepatopatie, rhabdomyolýza a náhlé úmrtí.
- Transportní poruchy beta-oxidace (v NLS od roku 2009)
- deficit karnitinpalmitoyltransferázy I (CPT I),
- transportní porucha beta-oxidace dlouhých mastných kyselin; raritní;
- klinický obraz u novorozenců: asymptomatičtí, nebo hypoketotická hypoglykémie, letargie, hepatomegalie a křeče, většinou vyvolané hladověním nebo akutní nemocí;
- léčba: frekventní strava (prevence hladovění) s vysokým obsahem sacharidů obohacených škroby a s nízkým obsahem tuků.
- deficit karnitinpalmitoyltransferázy II (CPT II),
- transportní porucha beta-oxidace dlouhých mastných kyselin; incidence neznámá;
- klasická adultní forma: epizodická svalová slabost s myalgií, rhabdomyolýzou a myoglobinurií, které jsou obvykle vyprovokované zvýšenou námahou, hladověním, infekcí, stresem nebo prochladnutím; infantilní forma je velmi vzácná.
- deficit karnitinacylkarnitintranslokázy (CACT),
- transportní porucha beta-oxidace dlouhých mastných kyselin; raritní.[6]
Dědičná porucha přeměny vitamínů[upravit | editovat zdroj]
- deficit biotinidázy (BTD) – v NLS od roku 2016,
- organická acidémie; incidence 1 : 60 000 narozených;
- klinický obraz dle tíže deficitu: asymptomatická či život ohrožující ketoacidóza, nebo pozvolné neurologické a zrakové a sluchové poškození.[6]
Spinální muskulární atrofie a těžká kombinovaná imunodeficience[upravit | editovat zdroj]
- pilotní projekt od ledna 2022, vyšetření je dobrovolné;
- provádí se z odebrané suché kapky, není potřeba odebrat více krve;
- screening metodou kvantitativní polymerázové řetězové reakce v reálném čase (qRT-PCR).[7]
Laboratoře pro novorozenecký screening[upravit | editovat zdroj]
Laboratorní vyšetření dědičných poruch metabolismu (DPM) metodou tandemové hmotnostní spektrometrie provádí:
- Všeobecná fakultní nemocnice, Ke Karlovu 2, 128 08 Praha 2, Ústav dědičných metabolických poruch;
- Fakultní nemocnice Olomouc, I.P.Pavlova, 775 20 Olomouc, Laboratoř dědičných metabolických poruch, OKBL.
Laboratorní vyšetření kongenitální hypotyreózy (CH), kongenitální adrenální hyperplazie (CAH) a cystické fibrózy (CF) pomocí imunoanalytických metod provádí:
- Fakultní nemocnice Královské Vinohrady, Šrobárova 50, 100 34 Praha 10, Laboratoř novorozeneckého screeningu, Klinika dětí a dorostu;
- Fakultní nemocnice Brno, Černopolní 9, 61300 Brno, pracoviště Dětská nemocnice, Oddělení klinické biochemie a hematologie.[3]
Laboratorní vyšetření SMA a SCID metodou kvantitativní polymerázové řetězové reakce v reálném čase provádí:
- Všeobecná fakultní nemocnice, Ke Karlovu 2, 128 08 Praha 2, Ústav dědičných metabolických poruch;
- Fakultní nemocnice Brno, Černopolní 9, 61300 Brno, Interní hematologická a onkologická klinika, Centrum molekulární biologie a genetiky.[7]
Poznámky[upravit | editovat zdroj]
- do roku 2009 se ke stanovení fenylalaninu v krvi používal Guthrieho test (semikvantitativní mikrobiologická zkouška):
- odebere se kapka krve na terčík filtračního papíru,
- filtrační papír se vloží do agarového média, ve kterém jsou bakteriální spory (obvykle Bacillus subtilis) a kompetitivní růstový inhibitor specifický pro hledanou aminokyselinu (pro fenylalanin beta-2-thienylalanin),
- inkubace,
- vyhodnocení růstu bakterií (bakterie rostou za přítomnosti fenylalaninu v kapce krve)[8],
- ještě dříve se používal močový test s chloridem železitým.