Vyšetření moči
Moč je snadno dostupnou biologickou tekutinou, jejíž analýzou získáváme cenné informace o stavu organismu a jeho metabolismu. Vyšetření moči patří mezi základní klinicko-biochemické postupy, které významně přispívají ke stanovení diagnózy, sledování průběhu onemocnění a výsledků léčby. Při analýze moči se využívá celé spektrum metod od nejjednodušších barevných a srážecích zkumavkových reakcí až po náročné a automatizované metody, jako je průtoková cytometrie nebo imunochemické analýzy. Díky diagnostickým proužkům lze základní vyšetření provést nejen v podmínkách laboratoře, ale přímo v ordinacích či u lůžka nemocného.
Sběr moči
Důležitým předpokladem validních výsledků analýzy moči je správný postup při jejím odběru a sběru.
První ranní moč
Pro většinu močových vyšetření je nejvhodnější první ranní moč. Doporučuje se, aby odběru moči předcházela alespoň osmihodinová poloha vleže. Ranní moč je koncentrovanější a kyselejší. Je vhodná zejména pro chemické vyšetření moče. Moč odebraná později je již ovlivněna příjmem tekutin, potravy a pohybem.
Moč se získává obvykle spontánní mikcí. Vlastní odběr moči se provádí po důkladném omytí a osušení zevního ústí uretry. Močí se do čistě vymyté, suché a uzavíratelné nádobky, v níž nesmí být zbytky čistících a dezinfekčních prostředků, které zkreslují výsledky chemické analýzy. K vyšetření je určen střední proud moči. První proud je vždy kontaminován buňkami a bakteriemi z okolí zevního ústí uretry. Proto první porci moči pacient vymočí do záchodu a do odběrové nádobky zachytí až druhý proud moči, ve kterém se provede analýza.
V určitých situacích se moč odebírá suprapubickou punkcí močového měchýře (chceme-li tzv. sterilní odběr) nebo katetrizací močového měchýře.
![]() Při odběru moči na mikrobiologické vyšetření nikdy neodebírámé ze sběrného sáčku, riziko kontaminace je až 80%[1]
Při odběru moči na mikrobiologické vyšetření nikdy neodebírámé ze sběrného sáčku, riziko kontaminace je až 80%[1]
U žen se vyhýbáme vyšetření v období těsně před menstruací až do jejího skončení. Pro většinu kvalitativních a semikvantitativních chemických analýz moči testovacími proužky není zapotřebí používat stabilizační přísady. V případě, že není možné vyšetření provést do 2 hodin po odběru, je vhodné moč uchovávat v lednici nebo ji konzervovat.
Při delším skladování se složení moči mění.
Druhá ranní moč
Je vzorek vymočený za 2–4 hodiny po prvním močení. Jeho složení je již ovlivněno příjmem potravy a tekutin a pohybem. Druhá ranní moč je doporučována především pro kvantitativní stanovení vztahovaná na koncentraci kreatininu v moči. Druhá ranní moč je také vhodná pro vyšetření močového sedimentu.
Náhodný vzorek moči
Náhodný vzorek moči je označení pro odběr čerstvé moči bez znalosti doby odběru a objemu a ani podrobnosti přípravy pacienta nebývají známy. Připadá v úvahu u akutních stavů. Analýza moči může být zatížena řadou chyb.
Časový sběr moči
Pro kvantitativní analýzy a pro stanovení clearance různých analytů je třeba moč sbírat v určitém časovém intervalu. Krátkodobý sběr moči trvá 1–3 hodiny, dlouhodobý 12–24 hodin. Někdy se provádí sběr moči přes noc (po dobu 8 hodin), např. pro stanovení albuminurie. Přesnost sběru je pro výsledky vyšetření velmi důležitá. Správnost sběru moči lze orientačně zkontrolovat stanovením koncentrace kreatininu v moči.
Moč se sbírá do dobře vyčištěných nádob uložených na chladném a temném místě, popř. s přídavkem konzervačního činidla.
Sběr může být zahájen kdykoliv během dne vyprázdněním močového měchýře a zaznamenáním času. Při 24hodinovém sběru je však nejvhodnější doba ráno mezi 6 a 7 hodinou. Na začátku sběru moči se pacient musí vymočit; tato porce se ještě nesbírá. Od tohoto okamžiku se sbírá veškerá moč. Pacienta je třeba poučit, že se do sběrné nádoby má vymočit i před tím, než jde na stolici. Sběr moči se ukončuje přesně za 24 hodin vymočením celého obsahu močového měchýře do sběrné nádoby.
Při časovém sběru moči se po jeho skončení změří objem moči, moč se důkladně promíchá a do laboratoře se obvykle dopraví minimálně 5 ml průměrného vzorku s údajem o přesném času zahájení a skončení sběru (s přesností na minuty) a s údajem o přesném objemu sesbírané moči.
Fyzikální vyšetření moči
Fyzikální vyšetření spočívá v posouzení barvy moči, jejího zápachu, pěny a zákalu. Důležitou součástí fyzikálního vyšetření je zjištění pH, hustoty a osmolality. Pro účel funkčních vyšetření je zapotřebí změřit objem moči za přesně definovaný časový úsek.
Objem
Denní objem moči je významně ovlivněn příjmem tekutin a stravy. Objemy menší než 400 ml/24 hodin a větší než 2500 ml/24 hodin se hodnotí jako patologické.
Oligurie a anurie
Oligurie je označení pro objem moči < 400 ml/24 hodin a anurie pro množství moči < 100 ml/24 hodin.
Oligurie a anurie jsou základním příznakem selhání ledvin. Příčinou může být dehydratace z nedostatečného příjmu tekutin nebo jejich zvýšené ztráty (průjmy, pocení). Snížený objem moči může být důsledkem primárního poškození ledvinného parenchymu nebo následek retence tekutin (edémy, výpotky v tělních dutinách).
Oligurii a anurii může zapříčinit i mechanická obstrukce v oblasti vývodných cest močových (hypertrofie prostaty, zaklíněný konkrement, nádory v oblasti malé pánve). Je-li překážka lokalizována pod močovým měchýřem, hovoříme o retenci moči.
Polyurie
Polyurií rozumíme zvýšení denní diurézy nad 2500 ml.
Rozlišují se dva druhy polyurických stavů:
- Polyurie podmíněná tzv. vodní diurézou.
- Vodní diuréza je dána snížením tubulární resorpce vody v distálním úseku nefronu. Tubulární resorpce a vylučování osmoticky aktivních látek je v mezích normy. Osmolalita moči je nižší než osmolalita séra. Vždy je menší než 250 mmol/kg H2O. S vodní diurézou se setkáváme fyziologicky při příjmu většího objemu vody nebo např. při nedostatečné sekreci antidiuretinu (diabetes insipidus).
- Polyurie podmíněná tzv. osmotickou diurézou.
- Je vyvolána buď zvýšenou filtrací osmoticky aktivních látek v důsledku jejich zvýšené osmotické koncentrace v ECT (např. hyperglykémie) nebo jejich sníženou tubulární resorpcí. Nevstřebané osmoticky aktivní látky na sebe „vážou“ vodu a výsledkem je snížení jejich tubulární resorpce. Osmolalita moči je vyšší než 250 mmol/kg H2O. Osmotická diuréza je příznačná např. pro diabetes mellitus nebo polyurickou fázi selhání ledvin či je výsledkem působení diuretik.
Barva
Čerstvá moč má jantarově žluté zbarvení, které se připisuje některým bilirubinoidům, zejména urobilinu. Intenzita zbarvení závisí na koncentraci a množství moči, které je dáno příjmem tekutin a extrarenálním výdejem. První ranní moč, jež je koncentrovanější, bývá tmavší. Některé patologické stavy nebo požití určitých exogenních látek mohou vyvolat změnu zbarvení (např. červená řepa, rebarbora). Vybrané charakteristické změny barvy moči jsou uvedeny v tabulce:
| Barva | Vyvolávající látka | Výskyt |
|---|---|---|
| žlutá až bezbarvá |
| |
| hnědá | bilirubin |
|
| zelenohnědá | biliverdin – vzniká z bilirubinu oxidací na vzduchu |
|
| žlutooranžová | karotenoidy, riboflavin |
|
| růžová až masově červená (bez zákalu) |
|
|
| růžová až masově červená se zákalem | krev v moči – hematurie
(mikroskopická hematurie, kterou lze prokázat pouze chemickým nebo mikroskopickým vyšetřením, neovlivní barvu moči) |
|
| Tmavě hnědá
(stáním na vzduchu se barva prohlubuje do černa) |
melanin
|
|
| Světle červená | uráty |
|
Zápach
Posuzujeme ho v čerstvé moči, protože stáním na světle se rozkládají některé součásti moči a zápach se mění. Charakteristický zápach vyvolávají některá onemocnění, uvedená v tabulce:
| Charakter zápachu | Příčina | Výskyt |
|---|---|---|
| Amoniakální | přítomnost bakterií produkujících ureázu, která katalyzuje rozklad močoviny na amoniak a oxid uhličitý |
|
| Acetonový (přezrálá jablka) | vylučování acetonu močí při ketoacidóze |
|
| Javorový sirup nebo maggi koření | karboxylové oxokyseliny s rozvětveným řetězcem (zejména kyseliny 2-oxoisokapronová, 2-oxoisovalerová) |
|
| sirovodíkový až hnilobný | bakteriálním rozkladem bílkovin se uvolňuje H2S z aminokyselin obsahujících síru |
|
| Myšina | fenylacetát |
Pěna
Normální moč pění málo, pěna je bílá a rychle mizí. Hojnější bezbarvá trvalejší pěna se vyskytuje při proteinurii. V přítomnosti bilirubinu je pěna moči zbarvena žlutě až žlutohnědě.
Zákal
Čerstvá moč je zpravidla čirá. Zákal, který vznikne po delší době stání, způsobují epitelie a nemá patologický význam. V čerstvé moči může být zákal vyvolán přítomností bakterií, leukocytů, lipidů, fosfátů, uhličitanů, kyselinou močovou, leucinem, tyrozinem a oxaláty. Lze jej rozlišit chemicky nebo mikroskopicky.
Hustota
V literatuře též specifická hmotnost.
Relativní hustota (též relativní specifická hmotnost) je dána hmotnostní koncentrací všech rozpuštěných látek vyloučených do moči. Na rozdíl od osmolality je závislá kromě počtu rozpuštěných částic také na jejich molekulové hmotnosti. Vysokomolekulární látky ovlivňují hustotu ve větší míře než elektrolyty. V případě výraznější glukosurie nebo proteinurie relativní specifická hmotnost stoupá. Koncentrace proteinů 10 g/l zvyšuje relativní specifickou hmotnost moči o 0,003 a koncentrace glukózy 10 g/l o 0,004. Relativní specifická hmotnost moči významně závisí na teplotě.
Relativní hustotou moči rozumíme poměr hustoty moči a hustoty vody. Hustota vody je prakticky rovna 1 kg/l, takže rozdíl mezi hustotou vody (v kg/l) a relativní hustotou moči je zanedbatelný. Hustota má v soustavě SI rozměr kg·m-3. Hustota vzorku vztažená na hustotu vody je relativní veličina a je tedy udána bezrozměrným číslem.
Stanovení hustoty moči
Hustota moči se pomocí diagnostických proužků odhaduje nepřímo podle koncentrace kationtů. Indikační zóna proužku obsahuje vhodný polyelektrolyt ve funkci iontoměniče a acidobazický indikátor bromtymolovou modř. Princip diagnostických proužků je založen na výměně kationtů z moči, zejména Na+, K+, NH4+, za ionty H+ polyelektrolytu v indikační zóně. Uvolněné H+ okyselí slabě pufrovaný acidobazický indikátor, který je v alkalické formě. Okyselení je doprovázeno změnou zbarvení bromtymolové modři. Nevýhodou je, že vyšetření diagnostickými proužky nebere v úvahu látky neelektrolytové povahy jako je glukóza, bílkoviny, močovina, kreatinin a některé další. Za fyziologických podmínek se hustota moči pohybuje v rozmezí 1,015–1,025. Při zřeďovacím a koncentračním pokusu mohou být dosaženy krajní hodnoty 1,003–1,040.
Zpravidla platí, že čím je větší objem moči, tím je její husta nižší (zředěná moč) a naopak při menším objemu moči (koncentrovaná moč) je vyšší. Z tohoto pravidla vybočují stavy, při nichž dochází k osmotické diuréze: např. při diabetes mellitus je objem moči větší s vyšší specifickou hmotností.
Stanovení hustoty umožňuje orientační odhad koncentrační schopnosti ledvin. Hodnoty nad 1,020 a vyšší jsou ukazatelem dobré renální funkce a schopnosti ledvin vyloučit nadměrné množství rozpuštěných látek. Vysoce koncentrovaná moč naznačuje podstatné snížení cirkulujícího plazmatického objemu.
Při neschopnosti ledvin koncentrovat moč je vylučována málo koncentrovaná moč o nízké specifické hmotnosti; hovoříme o hypostenurii. Nemocný vylučuje stejné množství pevných látek při vyšší spotřebě vody. Extrémně naředěná moč může být příznakem porušené koncentrační schopnosti ledvin, jako je tomu např. u diabetes insipidus, nebo v důsledku vedlejších účinků některých léků. Kombinace hypostenurie s polyurií svědčí o poškození renálního tubulárního systému.
Závažným příznakem poškození ledvin je izostenurie. Ledviny ztrácejí schopnost koncentrovat (i zřeďovat) moč a vylučují moč se stejnou hustotou jako je hustota glomerulárního filtrátu. Relativní hustota moči zůstává trvale nízká, přibližně kolem 1,010. Současný nález izostenurie s oligurií je ukazatelem těžké renální insuficience.
Ke zvýšení relativní relativní hustoty – hyperstenurii přispívá dehydratace, proteinurie nebo glykosurie.
| Označení | Relativní hustota | Příčiny |
|---|---|---|
| Eustenurie | 1,020–1,040 | |
| Hyperstenurie | > 1,040 | |
| Hypostenurie | < 1,020 |
|
| Izostenurie | 1,010 |
|
Specifická hmotnost moči - YouTube video
Osmolalita
Osmolalita moči závisí na množství osmoticky aktivních částic vyloučených do moči, přičemž nezáleží na jejich hmotnosti, velikosti ani elektrickém náboji. Osmolalita je vyjadřována v mmol/kg. Je jen přibližně závislá na hustotě moči. Její měření je ve srovnání s hustotou přesnější, má větší výpovědní hodnotu a dává se mu přednost. Porovnáme-li obě veličiny, odráží osmolalita celkovou látkovou koncentraci všech rozpuštěných látek, zatímco hustota jejich celkovou hmotnostní koncentraci. Zjednodušeně proto můžeme říci, že osmolalita bude více ovlivněna změnami koncentrace nízkomolekulárních látek (v praxi především sodíku, glukózy a urey), zatímco na hustotu bude mít výraznější vliv přítomnost bílkoviny v moči.
Normální hodnoty osmolality při běžném příjmu tekutin jsou 300–900 mmol/kg. Osmolalita moči závisí na zřeďovací a koncentrační schopnosti ledvin. Krajní hodnoty osmolality při maximálním zředění nebo maximální koncentraci se pohybují v rozmezí 50–1200 mmol/kg. Je-li osmolalita moči přibližně stejná jako osmolalita krve, jde o izoosmolální moč. Moč hypoosmolální má nižší osmolalitu než krev, tj. nižší než asi 290 mmol/kg. Jako hyperosmolální moč se označuje moč o vyšší osmolalitě než vykazuje krev.
Teoreticky si můžeme představit, že definitivní moč vzniká z izoosmolálního glomerulárního filtrátu, ke kterému se v renálních tubulech přidává nebo se z něj naopak resorbuje čistá, tzv. bezsolutová voda.
Transport bezsolutové vody vyjadřuje její clearance. Co tato veličina znamená, si vysvětlíme pomocí následujících úvah: Nejprve definujme clearance osmoticky aktivních látek. Jde o veličinu analogickou běžně používané clearance endogenního kreatininu: clearance osmoticky aktivních látek představuje teoretický objem krevní plazmy, který je za jednotku času v ledvinách zcela zbaven všech osmoticky aktivních částic. Bude platit (odvození je obdobné jako u clearance endogenního kreatininu):
- ,
| kde | Closm | je osmolární clearance v ml/s, |
| V | je diuréza v ml/s | |
| Uosm | je osmolální koncentrace moči v mmol/kg vody, | |
| Posm | je osmolální koncentrace plazmy v mmol/kg vody. |
Má-li primitivní moč stejnou osmolalitu jako plazma a zanedbáme-li příspěvek bílkovin k celkové osmolalitě plazmy, musí být objem přefiltrované primitivní moči stejný jako clearance osmoticky aktivních částic Closm.
Jako clearance bezsolutové vody se označuje rozdíl mezi skutečným objemem definitivní moči vyloučené za jednotku času a osmolální clearance:
| kde | ClH2O | je clearance bezsolutové vody v ml/s, |
| Closm | je osmolální clearance v ml/s, | |
| V | je diuréza v ml/s. |
Je-li clearance bezsolutové vody záporná, znamená to, že se z primitivní moči část bezsolutové vody resorbovala, takže definitivní moč je osmoticky koncentrovanější. Pokud by naopak byla clearance bezsolutové vody pozitivní, vznikala by hypoosmolální moč, proti krevní plazmě naředěná bezsolutovou vodou. Fyziologické hodnoty se pohybují mezi −0,027 a −0,007 ml/s.
Ledviny jsou schopné vyloučit velké množství bezsolutové vody, aby se zabránilo hyponatremii. Naopak při nedostatku vody je omezováno její vylučování a částice se vyloučí v menším objemu vody.
Stanovení osmolality moči
Osmometrem
K přesnému stanovení osmolality slouží osmometry. Využívají toho, že rozpuštěné částice ovlivňují některé vlastnosti roztoku:
- snižují bod tuhnutí roztoku (kryoskopický princip);
- zvyšují bod varu roztoku (ebulioskopický princip);
- snižují tlak par rozpouštědla nad roztokem.
Velikost změny výše uvedených veličin závisí na koncentraci osmoticky aktivních látek v měřeném roztoku a osmometry tyto změny zaznamenávají s velkou přesností. Obvykle se zjišťuje snížení bodu tuhnutí. Platí, že 1 mol částic nějaké látky rozpuštěné v 1 kg vody snižuje její bod tuhnutí o 1,86 °C.
Orientačně výpočtem na základě hodnot látkové koncentrace Na+, K+, NH4+ a močoviny v moči
- Osmolalita v moči = 2([Na+] + [K+] + [NH4+]) + [močovina]
Tento výpočet selhává, pokud moč obsahuje vysokou koncentraci jiných látek, které fyziologicky bývají přítomné v řádově nižších množstvích – např. při výrazné glykosurii či ketonurii.
Orientačně výpočtem z hodnoty relativní hustoty
- Pokud moč neobsahuje bílkovinu ani cukr
- poslední dvojčíslí hodnoty relativní hustoty vynásobíme faktorem 33.
- Pokud moč obsahuje bílkovinu nebo cukr
- hodnotu relativní hustoty musíme nejprve korigovat
- v přítomnosti bílkoviny na každých 10 g/l odečítáme od hodnoty relativní hustoty 0,003;
- v přítomnosti glukózy na každých 10 g/l odečítáme od hodnoty relativní hustoty 0,004.
Vyšetření koncentrační schopnosti ledvin
Porucha koncentrační schopnosti ledvin patří k prvním známkám renálního onemocnění. Při jejím vyšetřování postupujeme následujícím způsobem:
- Nejprve vyšetříme osmolalitu v ranním vzorku moči. Zdravý člověk by měl po nočním odnětí tekutin vytvořit moč o osmolalitě kolem 600 mmol/kg. Tato hodnota svědčí o dobré koncentrační schopnosti ledvin a je-li jí dosaženo, v dalším vyšetřování nepokračujeme.
- Adiuretinový test odráží schopnost distálního tubulu a sběrného kanálku reagovat na adiuretin (vasopresin) tvorbou koncetrované moči. Pacientovi aplikujeme po nočním odnětí tekutin do každé nosní dírky 10 μg (2 kapky) 1-deamino-8-D-arginin vazopresinu (DDAV), což je syntetický analog adiuretinu. Vyznačuje se vystupňovaným antidiuretickým účinkem, zatímco ostatní farmakologické účinky jsou potlačeny. Pacient sbírá moč ve čtyřech jednohodinových intervalech a měří se osmolalita jednotlivých vzorků moči. Jestliže přesáhne hodnotu uvedenou v tabulce, svědčí to o dobré koncentrační schopnosti ledvin a pokus ukončíme. Současně s močí se odebírá krev, v níž se vyšetřuje sérová osmolalita. Z hodnot osmolality v moči a v séru vypočítáme osmotický index (Uosm/Sosm), který přesněji odráží koncentrační schopnost ledvin.
Fyziologické hodnoty osmolality moči a osmotického indexu po podání adiuretinu Věk Ummol/kg H2O Uosm/Sosm 15–20 970 3,34 21–50 940 3,24 51–60 830 2,86 61–70 790 2,72 71–80 780 2,69
Jinou možností je hodnocení osmolality moči za podmínek různě dlouho trvajícího odnětí tekutin, které se v současnosti provádí zřídka.
Koncentrační schopnost ledvin je porušena hlavně u onemocnění postihujích ledvinné tubuly a intersticium, kde dochází k narušení protiproudového koncentračního gradientu.
Lze vyšetřovat i zřeďovací schopnost ledvin po zátěži destilovanou vodou. Test odráží schopnost vytvářet moč, jejíž osmolalita je výrazně nižší, než je osmolalita séra.
pH
Ledviny jsou orgánem, kde se uskutečňuje úprava acidobazické rovnováhy vyloučením (popř. zadržením) H+. V glomerulárním filtrátu je pH stejné jako v plazmě. Při průchodu renálním tubulárním systémem nastává acidifikace moči.
Koncentrace volných protonů je v moči ve srovnání s jinými ionty zanedbatelná; můžeme proto říci, že H+ je ledvinami eliminován ve dvou formách:
- vázaný na přítomné anionty, např. na fosfáty (přeměna hydrogenfosforečnanu na dihydrogenfosforečnan)
- H+ + HPO42- → H2PO4-
- nebo na anionty některých organických kyselin. Tento podíl se označuje jako tzv. titrovatelná acidita, která za normálních podmínek představuje 10–30 mmol/24 hodin. Lze ji stanovit titrací hydroxidem sodným.
- jako amonný kationt, který představuje nejvýznamnější systém.
- H+ + NH3 → NH4+
- Množství NH4+ vyloučeného močí se pohybuje mezi 30–50 mmol/24 hodin.
pH moči závisí:
- na složení stravy
- U zdravého člověka je pH moči ovlivněno nejvíce složením stravy. Laktovegetariánský způsob stravování způsobuje alkalizaci moči. Naopak strava bohatá na bílkoviny (maso) je doprovázena acidifikací.
- na stavu acidobazické rovnováhy
- Za patologických okolností odráží pH moči poruchy acidobazické rovnováhy. Změny pH moči jsou projevem kompenzační a korekční činnosti ledvin. Acidurie je důsledkem korekce metabolické a kompenzace respirační acidózy, alkaliurie je na počátku kompenzace respirační a korekce metabolické alkalózy. Vylučování kyselé moči při acidóze a alkalické při alkalóze platí však pouze při lehčích poruchách a dobře fungujících ledvinách. Současný nález acidurie a ketonurie svědčí pro hladovění. Kombinace acidurie, ketonurie a glykosurie bývá u dekompenzace diabetu mellitu.
Nejčastější faktory ovlivňující pH moči Kyselé pH Zásadité pH proteinová dieta vegetariánská strava dehydratace renální tubulární acidóza diabetická ketoacidóza respirační a metabolická alkalóza metabolická a respirační acidóza bakteriální infekce močových cest hladovění
Trvale alkalické pH moči může signalizovat:
- Infekci ledvin či močových cest bakteriemi, produkujícími ureázu. Enzymovou hydrolýzou močoviny vzniká amoniak, který moč alkalizuje. Podobná situace je i u bakteriálně kontaminované moči, v níž došlo při delší době skladování k přemnožení bakterií.
- H2N-CO-NH2 + H2O 2NH3 + CO2
- NH3 + H2O → NH4+ + OH-
- Renální tubulární acidózu distálního typu, což je porucha renálních tubulárních buněk charakterizovaná neschopností distálního tubulu vylučovat H+.
Hlavní přínos vyšetření pH moči je v diagnostice a léčení močové infekce a urolitiázy. Trvalé odchylky pH moči mohou být jedním z faktorů přispívajících k tvorbě močových konkrementů.
- V kyselé moči jsou obvyklé konkrementy z oxalátu vápenatého. Při kyselém pH se snadno vytvářejí i konkrementy z kyseliny močové. Alkalizace moči nad hodnotu pH 7,0 může vést za příznivých okolností k pomalému rozpouštění kamenů z kyseliny močové a zabránění jejich tvorbě. V kyselé moči také snáze precipituje cystin.
- V alkalické moči jsou špatně rozpustné fosforečnany a při pH nad 7 z roztoku vypadávají fosforečnan amonno-hořečnatý (struvit – MgNH4PO4·6H2O) a směs fosforečnanu a uhličitanu vápenatého [„karbonátapatit“ – Ca10(PO4CO3OH)3 (OH)3].
Stanovení pH moči
pH moči je nutno vyšetřovat vždy v čerstvé moči. Obvykle je stanovováno diagnostickými proužky. Přesné stanovení pH lze provést pH-metrem.
Fyziologické pH moči je v rozmezí 5,0–6,5, krajní hodnoty jsou 4,5–8,0. Extrémní hodnoty v kyselé nebo zásadité oblasti budí podezření z nedodržení pokynů při odběru moči.
Vyšetření acidifikační činnosti ledvin
Základním vyšetřením umožňujícím posoudit acidifikační činnost ledvin je vyšetření pH vzorku ranní moči. Stanovení pH je zapotřebí provést ihned a doporučuje se použít pH-metr. U zdravého dospělého je pH ranního vzorku nižší než 6,0. Při vyšší hodnotě vzniká podezření na poruchu acidifikační schopnosti, a pokud nejsou kontraindikace (např. výrazné omezení funkce ledvin), je možno provést acidifikační test po zátěži NH4Cl nebo CaCl2 (u pacientů s poruchou jaterní funkce). Pacientovi podáme chlorid amonný (2 mmol na kg tělesné hmotnosti). Za 3 hodiny po požití testovací látky následuje sběr moči ve 3 jednohodinových intervalech a ihned po odběru se ve vzorcích moči změří kyselost pH-metrem. Při neporušené acidifikační funkci ledvin by pH moči mělo klesnout pod hodnotu 5,5.
Acidifikační schopnost je porušena u pacientů s renální tubulární acidózou distálního typu.
V případě nejednoznačného výsledku acidifikačního testu se vyšetřuje alkalizační schopnost ledvin po orální nebo intravenózní zátěži hydrogenuhličitanem sodným.
Chemické vyšetření moči
Běžně se v moči kvalitativně zjišťuje bílkovina, glukóza, hemoglobin, ketolátky a žlučová barviva. Tyto součásti se většinou vyskytují i v moči zdravých osob, ale v tak malém množství, že je běžnými zkouškami neprokážeme. Za různých patologických stavů se jejich koncentrace v moči zvyšuje.
Zkumavkové reakce
Dříve se k průkazu patologických součástí moči používaly barevné a srážecí reakce prováděné tzv. „mokrou cestou“ (ve zkumavkách). Souhrnně jsou jejich principy v tabulce:
| Analyt | Princip reakce | Jednotlivé zkoušky |
|---|---|---|
| Bílkovina | denaturace bílkovin |
|
| Hemoglobin | pseudoperoxidázová aktivita hemového železa – katalyzuje oxidaci vhodných chromogenů na barevné produkty
peroxidem vodíku |
|
| Glukóza | nespecifické zkoušky založené na redukčních vlastnostech glukózy |
|
| Ketolátky | reakce s nitroprusidem sodným v alkalickém prostředí za vzniku fialového komplexu | |
| Bilirubin | oxidace bilirubinu na zelený biliverdin nebo modrý bilicyanin |
|
| Urobilinogen | reakce urobilinogenu s 4-dimethylaminobenzaldehydem v kyselém prostředí za vzniku barevného kondenzačního produktu |
Testovací (diagnostické) proužky
Průkaz patologických součástí moči přímo u lůžka nemocného nebo v linii prvního kontaktu s pacientem umožňuje vyšetřování pomocí testovacích proužků.
Testovací proužky jsou tvořeny nosičem z umělé hmoty, na němž jsou upevněny jedna nebo více indikačních zón. Ty jsou vyráběny tak, že do vhodného materiálu (např. speciální filtrační papír) se nasaje kapalné analytické činidlo, které se šetrně vysuší.
Diagnostické proužky se dodávají jako monofunkční, polyfunkční nebo proužky pro speciální vyšetření.
Monofunkční proužky obsahují základní indikační zóny pro semikvantitativní stanovení určité látky v moči. Polyfunkční proužky jsou tvořeny několika indikačními zónami, umožňujícími vyšetření několika biochemických parametrů najednou. Jsou určeny pro případy, kdy je zapotřebí získat co nejvíce informací o zdravotním stavu pacienta, např. při různých screeningových akcích. Kromě monofunkčních a polyfunkčních proužků existují proužky pro speciální vyšetření, kde jsou zařazeny kombinace dvou nebo více indikačních zón, které jsou zvoleny pro vyšetření určitého onemocnění, např. proužky pro screening diabetes mellitus obsahují zónu pro stanovení glukózy, ketolátek, bílkoviny a pH.
Pomocí testovacích proužků lze stanovit tyto parametry v moči:
Principy stanovení jednotlivých parametrů
Bílkovina
Princip stanovení bílkovin v moči pomocí diagnostických proužků je založen na tzv. bílkovinné chybě acidobazického indikátoru, např. tetrabromfenolové modři, etylesteru tetrabromfenolftaleinu či 3´,3´´,5´,5´´-tetrachlorfenol-3,4,5,6-tetrabromsulfoftaleinu. Jako každý acidobazický indikátor tyto látky při určitém pH mění svou barvu (chovají se jako slabé kyseliny, přičemž protonovaná forma má jiné zbarvení než disociovaná forma): při pH nižším než 3,5 jsou žluté, při vyšším pH jsou zelené až modré. V reakční zóně testovacího proužku je kromě indikátoru i pufr, který udržuje pH v rozmezí 3,0 až 3,5, indikátor tedy má žlutou barvu. Jsou-li ve vzorku bílkoviny, naváží se svými aminoskupinami na indikátor. Tím ovšem změní jeho vlastnosti – přechodová oblast se posune směrem ke kyselejšímu pH. Znamená to, že při uvedeném konstatním pH mezi 3,0 až 3,5 bude mít indikátor s navázanou bílkovinou zelenou barvu, jako kdyby byl v alkaličtějším prostředí (proto bílkovinná chyba indikátoru). Intenzita zbarvení závisí na koncentraci bílkoviny, kolísá od zelené až po modrou a hodnotí se vizuálně nebo instrumentálně.
U výrazně alkalických močí (pH nad 8) nebo je-li moč velmi koncentrovaná, může test dávat falešně pozitivní výsledky (dojde k vyčerpání pufru v reakční zóně). V těchto případech moč okyselíme několika kapkami zředěné kyseliny octové na pH 5–6 a test opakujeme. Falešnou pozitivitu mohou také způsobit vysoké koncentrace některých látek s aminoskupinami (kontaminace odběrové nádoby některými dezinfekčními prostředky), jež se na indikátory váží podobně jako bílkoviny.
Nevýhodou testovacích proužků je jejich rozdílná citlivost vůči jednotlivým bílkovinám. Proužky reagují velmi dobře s albuminem a jeho přítomnost indikují v moči od 0,1 až 0,5 g/l. Podstatně nižší citlivost vykazují vůči globulinům, glykoproteinům a Bence-Jonesově bílkovině. Těmito diagnostickými proužky nelze prokázat zvýšení albuminurie na hodnoty do asi 200 mg/l, resp. denní ztráty albuminu v rozmezí 30 až 300 mg/24 hodin, které provází zejména časnější fáze některých nefropatií. Pro skrínink zvýšení albuminurie je možno použít imunochemických metod, např. speciálních diagnostických proužků založených na imunochromatografickém principu nebo imunoturbidimetrie.
Hemoglobin
Hemoglobin katalyzuje, podobně jako peroxidáza, oxidaci (dehydrogenaci) některých substrátů (např. derivátů benzidinu) peroxidem vodíku:
Nejedná se však o enzymovou aktivitu (katalýzu podmiňuje hemové železo), a proto se neztrácí ani po tepelné denaturaci. Hovoříme o pseudoperoxidázové aktivitě, která se využívá k citlivým, ale nespecifickým důkazům hemoglobinu nebo stopových množství krve. Výhodné je ke sledování reakce použít chromogenní substrát, tj. látku poskytující dehydrogenací výrazně zbarvený produkt (často benzidin nebo jeho nekancerogenní deriváty, aminofenazon apod.).
Reagenční zóna diagnostických proužků obsahuje chromogen (např. tetrametylbenzidin) se stabilizovaným peroxidem vodíku (např. kumenhydroperoxidem). V přítomnosti volného hemoglobinu (hemoglobinurie) se indikační zóna zbarví rovnoměrně modře. Pokud jsou v moči přítomny erytrocyty (erytrocyturie), vytvářejí se intenzivně zelenomodře zbarvené tečky až skvrny.
S hemoglobinurií se můžeme setkat u intravaskulární hemolýzy. K častější erytrocyturii vede jak poškození glomerulární membrány (glomerulární hematurie), tak krvácení z jakékoliv části vývodných cest močových. Často ji nacházíme u infekcí močových cest, urolitiázy a nádorů urogenitálního traktu.
Kromě hemoglobinu poskytuje pseudoperoxidázovou reakci i myoglobin, který se může do moči vylučovat při rozpadu kosterního svalstva (rabdomyolýza, crush-syndrom). Pozitivita zkoušky může být způsobena i peroxidázami leukocytů či některých bakterií, kvasinek nebo plísní, které se mohou vyskytovat v moči zejména při infekcích močových cest. Chceme-li vyloučit možnost falešně pozitivní reakce účinkem buněčných peroxidáz, je nutno reakci provádět s povařenou močí.
Kontaminace odběrové nádoby silnými oxidačními činidly rovněž vyvolává falešnou pozitivitu reakce. Na druhé straně může přítomnost silně redukujících látek (např. kyselina askorbová) zpomalit až zastavit pseudoperoxidázovou reakci a být tak příčinou falešně negativních výsledků.
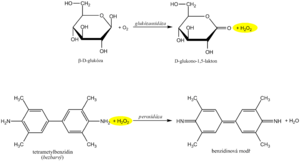
Glukóza
Diagnostické proužky pro průkaz glukózy v moči jsou založeny na principu enzymových reakcí s glukózaoxidázou a peroxidázou (stejný princip jako stanovení glykémie). D-glukóza je pomocí glukózaoxidázy oxidována kyslíkem a vzniká D-glukono-1,5-lakton a peroxid vodíku. V následné peroxidázové reakci peroxid vodíku oxiduje tetrametylbenzidin či jiný chromogen na barevný produkt. Světle žluté zbarvení reakční plošky se při pozitivitě mění na modrozelené. Test je specifický pro D-glukózu, jiné cukry neposkytují pozitivní reakci.
Vysoké koncentrace redukujících látek jako je kyselina askorbová zpomalují vývin zbarvení a mohou vést k falešně nižším výsledkům. V těchto případech se doporučuje opakovat analýzu minimálně 10 hodin po vysazení vitaminu C. Naopak falešně pozitivní výsledky mohou být způsobeny přítomností peroxidu vodíku či oxidačních činidel (některé dezinfekční prostředky) v odběrové nádobě. Stanovení glukózy v moči je nutno provést rychle, aby se zamezilo kontaminaci bakteriemi, nebo moč uchovávat při 4 °C.
Interference s kyselinou askorbovou je častým zdrojem falešných negativit. Diagnostické proužky pro vyšetření moči od některých výrobců jsou proto upraveny tak, aby reakční zóna byla vůči kyselině askorbové alespoň do určité míry odolná. Některé diagnostické proužky také mají detekční zónu pro askorbát, která na možnost falešné negativity upozorní.
Glukosurie nejčastěji provází vzestup glykemie nad tzv. renální práh glukózy (kolem 10 mmol/l). Glukóza, která se normálně filtruje přes glomerulární membránu, je v primitivní moči v tak vysoké koncentraci, že nestačí být resorbována v tubulech a dostává se do definitivní moči. Glukosurie při normální glykemii svědčí pro poruchu tubulárních transportních mechanismů – hovoříme o renální glukózurii.
Ketolátky
Průkaz ketolátek je založen na reakcích kyseliny acetoctové a acetonu s nitroprusidem sodným v alkalickém prostředí, kdy vzniká červenofialově zbarvený komplex[2]. Tento princip využívá Legalova a Lestradetova zkouška, stejně tak jsou na něm postaveny i diagnostické proužky. Kyselina β-hydroxymáselná (tedy nejhojněji zastoupená ketolátka) reakci neposkytuje, a proto negativní výsledek ketoacidózu zcela nevylučuje[3].
Falešnou pozitivitu zkoušek na ketolátky v moči poskytují sloučeniny s volnými sulfhydrylovými skupinami (např. antihypertenzivum kaptopril či uroprotektivum užívané v některých chemoterapeutických schématech mesna)[2]. Poměrně často poskytují podobnou reakci také produkty bakterií při infekcích močových cest.
Falešné negativity kromě již uvedené necitlivosti zkoušek ke kyselině β-hydroxymáselné nejsou významné.
Viz též Ketolátky v moči.
Bilirubin
Průkaz bilirubinu v moči pomocí diagnostických proužků je založen na azokopulační reakci, kterou poskytuje konjugovaný bilirubin se stabilní diazoniovou solí (např. 2,6-dichlorbenzendiazoniumtetrafluoroborát). Vzniká růžové až růžovočervené barvivo. Při současném výskytu vysokých koncentrací urobilinogenu se zbarvení mění do oranžova. V tomto případě se doporučuje vyhodnotit zbarvení až po 2 minutách od namočení indikační zóny. Nižší až falešně negativní výsledky mohou být způsobeny vysokými koncentracemi kyseliny askorbové. Vzorky moči je nutno chránit před přímým slunečním světlem, které vyvolává oxidaci bilirubinu s následným falešně nižším až negativním nálezem.
V moči se vyšetřuje pouze konjugovaný bilirubin, neboť nekonjugovaný bilirubin se do ní nemůže vyloučit.
Urobilinogen
Pro stanovení urobilinogenu v moči se podobně jako u bilirubinu využívá princip azokopulační reakce se stabilní diazoniovou solí (např. 4-metoxybenzendiazoniumtetrafluoroborát). Indikační zóna se barví v přítomnosti urobilinogenu růžově až červeně. Slabě růžové zbarvení odpovídá ještě fyziologickému vylučování urobilinogenu. V přítomnosti bilirubinu je zbarvení žluté, které přechází po 1 minutě do zeleného až modrého odstínu.
Falešnou pozitivitu mohou způsobit některé heterocyklické dusíkaté látky produkované bakteriemi při infekcích močových cest. Falešnou negativitu mohou způsobovat vysoké koncentrace askorbátu.
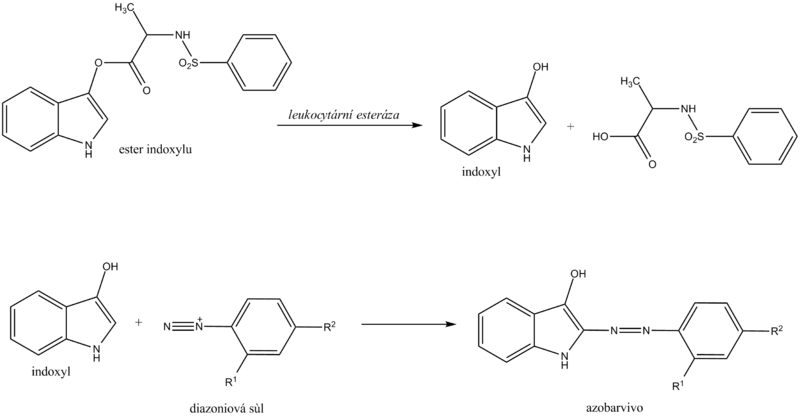
Leukocyty
Chemické stanovení leukocytů diagnostickým proužkem je založeno na průkazu esteráz, které jsou hojné v granulocytech. Granulocytární esterázy katalyzují hydrolýzu esteru indoxylu na volný indoxyl. Indoxyl pak reaguje se stabilní diazoniovou solí na příslušné azobarvivo. Při negativní reakci je zóna zbarvena krémově žlutě, při pozitivní reakci se mění do růžového až fialového odstínu.
Vyšetření leukocytů chemickou cestou nenahrazuje mikroskopické vyšetření. Na druhé straně je možné tímto způsobem prokázat i lyzované leukocyty (např. v hypotonické moči), což mikroskopické vyšetření neumožňuje.
Leukocyturie je příznakem zánětu ledvin nebo močových cest. Příčinou většiny pozitivních nálezů bývá bakteriální infekce močových cest. Při pozitivním nálezu leukocytů se doporučuje doplnit vyšetření proteinurie, hematurie, nitriturie, vyšetření močového sedimentu a dále mikrobiologické vyšetření.
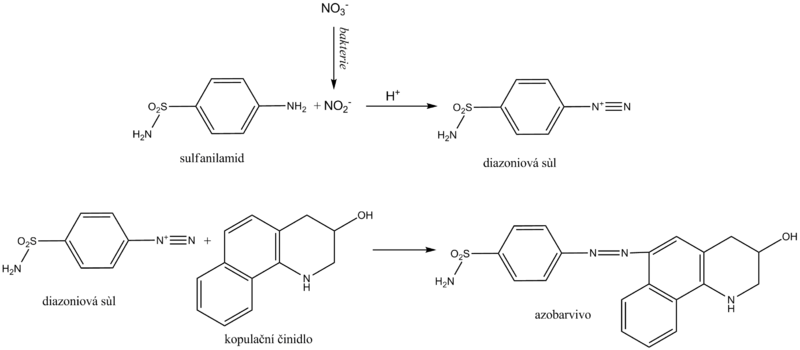
Dusitany
Dusitany se v moči stanovují jako nepřímá známka bakteriurie. Normální moč je v měřitelných koncentracích neobsahuje. Některé především gramnegativní bakterie, jako je Escherichia coli, Proteus, Klebsiella, ale také některé stafylokoky a další, mají schopnost redukovat dusičnany přítomné v moči na dusitany. Diagnostické proužky na nepřímý průkaz bakteriurie využívají dusitanů v tzv. Griessově reakci. Její podstatou je diazotace sulfanilamidu dusitany ve vzorku za vzniku diazoniové soli. Následuje azokopulace vzniklé soli s kopulačním činidlem za vývinu růžového až fialového zbarvení.
Vyšetření moči na dusitany je zapotřebí provádět v první ranní moči, neboť v tomto případě je zaručena dostatečně dlouhá doba nezbytná pro bakteriální redukci dusičnanů na dusitany v močovém měchýři. Dalším doporučením je konzumace dostatku zeleniny (obsahuje dusičnany) den před vyšetřením. Pozitivní průkaz dusitanů v moči potvrzuje bakteriurii, zatímco negativní ji nevylučuje.
Nepřímý průkaz bakteriurie je orientační a nenahrazuje mikrobiologické vyšetření.
Kyselina askorbová
Kyselina askorbová se v moči objevuje při vysokém příjmu potravou. Jako silné redukční činidlo může ovlivnit stanovení některých analytů v moči, zejména těch, které při reakcích využívají peroxid vodíku. Ten je kyselinou askorbovou přímo redukován. Rovněž rychle rozkládá diazoniové sole používané k azokopulačním reakcím.
Princip detekce kyseliny askorbové využívá kyselinu fosfomolybdenovou, která je kyselinou askorbovou redukována na molybdenovou modř. Reakce není specifická pouze pro kyselinu askorbovou, podobně reagují i jiné látky se silnými redukčními účinky.
pH
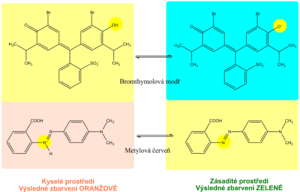
Indikační zóna pro pH obsahuje směs vybraných acidobazických indikátorů. Většina využívá dva acidobazické indikátory – metylovou červeň a bromthymolovou modř, popř. fenolftalein. Tím je zabezpečeno odečítání pH v rozsahu 5–9 změnou barvy z oranžové (kyselé pH) na zelenou až modrou (alkalické pH). Odečet je možný s přesností na 0,5.
Hustota
Relativní hustotou moči rozumíme poměr hustoty moči a hustoty vody. Hustota vody je prakticky rovna 1 kg/l, takže rozdíl mezi hustotou vody (v kg/l) a relativní hustotou moči je zanedbatelný. Hustota má v soustavě SI rozměr kg·m-3. Hustota vzorku vztažená na hustotu vody je relativní veličina a je tedy udána bezrozměrným číslem.
Stanovení hustoty moči
Hustota moči se pomocí diagnostických proužků odhaduje nepřímo podle koncentrace kationtů. Indikační zóna proužku obsahuje vhodný polyelektrolyt ve funkci iontoměniče a acidobazický indikátor bromtymolovou modř. Princip diagnostických proužků je založen na výměně kationtů z moči, zejména Na+, K+, NH4+, za ionty H+ polyelektrolytu v indikační zóně. Uvolněné H+ okyselí slabě pufrovaný acidobazický indikátor, který je v alkalické formě. Okyselení je doprovázeno změnou zbarvení bromtymolové modři. Nevýhodou je, že vyšetření diagnostickými proužky nebere v úvahu látky neelektrolytové povahy jako je glukóza, bílkoviny, močovina, kreatinin a některé další.
Postup při vyšetření diagnostickými proužky
Z tuby vyjmeme jen tolik proužků, kolik budeme bezprostředně potřebovat. Tubu se zbývajícími proužky ihned uzavřeme, abychom nepoužité proužky chránili před vlhkostí. Nedotýkáme se rukou indikační zóny proužků. Proužky uchováváme pouze v originálních obalech a dobře uzavřené se sáčkem se sušidlem, v temnu, na suchém místě při teplotě +2 až +30 °C.
Proužek ponoříme krátce na 1–2 s do vyšetřované moči tak, aby byly všechny zóny smočeny. Poté proužek vyjmeme a přebytek moči odstraníme otřením hrany proužku o okraj nádoby. Pak jej uložíme do vodorovné polohy, aby se zabránilo smíchání činidel z jednotlivých reagenčních plošek. Po uplynutí předepsané reakční doby, obvykle 60 s a pro leukocyty 120 s, vyhodnotíme.
Hodnocení zabarvení reakčních zón diagnostických proužků se provádí:
- subjektivním srovnáním výsledného zbarvení s barevnou stupnicí na štítku tuby, v níž jsou proužky uloženy;
- objektivně pomocí reflexních fotometrů, které měří intenzitu světla vhodné vlnové délky odraženého od reakčního políčka.
Přehled vyšetření moči pomocí diagnostických proužků
| Analyt | Princip | Falešně pozitivní výsledky | Falešně negativní výsledky |
|---|---|---|---|
| Bílkovina | Proteinová chyba acidobazického indikátoru | Alkalické pH, znečištění odběrové nádoby dezinfekčními prostředky na bázi kvarterních amoniových solí, menstruace (nevyšetřujeme 3 dny před a po), hemoglobinurie, myoglobinurie | Globuliny a lehké řetězce imunoglobulinů jsou těžko prokazatelné |
| Hemoglobin | Oxidace chromogenu peroxidem vodíku účinkem pseudoperoxidázové aktivity hemoglobinu | Mikrobiální peroxidázy, kontaminace nádob oxidačními čistícími prostředky | Vysoká koncentrace dusitanů, vitamin C |
| Glukóza | Glukózaoxidázová reakce spřažená s peroxidázovou reakcí | Kontaminace nádob oxidačními čistícími prostředky | Vitamin C, další redukující látky (kyselina gentisová, DOPA), močová infekce |
| Ketolátky | Reakce kyseliny acetoctové a acetonu s nitrprusidem v alkalickém prostředí | Látky s volnými sulfhydrylovými skupinami (např. kaptopril). Některé látky na bázi fenolftaleinu a sulfoftaleinu (laxancia a diagnostika) poskytují v alkalickém prostředí podobné zbarvení. Kyselina fenylpyrohroznová. | β-hydroxybutyrát nereaguje |
| Bilirubin | Azokopulační reakce | Látky, které mají v kyselém prostředí podobné zbarvení, dusíkaté metabolity bakterií u některých močových infekcí | Vysoký obsah dusitanů, expozice světlu, kyselina askorbová |
| Urobilinogen | Azokopulační reakce | Látky, které mají v kyselém prostředí podobné zbarvení, dusíkaté metabolity bakterií u některých močových infekcí | Formaldehyd, expozice světlu, stará moč, kyselina askorbová |
| Dusitany | Griessova reakce – diazotace sulfanilamidu dusitany a následná azokopulace | Bakteriální kontaminace | Nedostatek dusičnanů ve stravě, Gram-pozitivní bakterie, velká diureza, vitamin C |
| Leukocyty | Esterázová aktivita granulocytů a makrofágů | Formaldehyd, alkalické pH, vysoká hustota moči | Vitamin C, některé léky |
| pH | Směs acidobazických indikátorů | Formaldehyd (zdánlivě nižší pH), stará moč (alkalické pH) | |
| Hustota | Iontová výměna kationtů moči za H+, stanovení pH acidobazickým indikátorem | Alkalické pH posouvá výsledky k nižším hodnotám |
Vyšetření močového sedimentu
Morfologické součásti moči lze zjistit mikroskopickým vyšetřením močového sedimentu a nověji i průtokovou cytometrií.
Analýza močového sedimentu nepatří ke screeningovým postupům. K jeho analýze přistupujeme v těchto indikacích:
- při pozitivním nálezu chemického vyšetření moči (pozitivní erytrocyty, bílkovina, dusitany);
- při pozitivním výsledku vyšetření leukocytů diagnostickými proužky;
- při klinickém podezření na onemocnění ledvin a vývodných cest močových;
- při kontrolním vyšetření pacientů s nefrologickým nebo urologickým onemocněním.
Orientační vyšetření močového sedimentu
Orientačně pomocí diagnostických proužků lze prokázat erytrocyty, leukocyty a bakteriurii nepřímo zkouškou na nitrity (tab. 1). Při pozitivním nálezu pomocí proužků je nutno provést náročnější mikroskopické vyšetření. Použití diagnostických proužků však sníží zbytečné požadavky na mikroskopické hodnocení. Proužky se uplatní i v případě, kdy se buněčné elementy rozpadnou vlivem nízké osmolality či vysokého pH moči, při dlouhém stání vzorku či při vyšší pokojové teplotě. Nález v močovém sedimentu je negativní, ale o přítomnosti rozpadlých erytrocytů a/nebo leukocytů může svědčit pozitivní nález při vyšetření testovacím proužkem. Pseudoperoxidasová aktivita hemoglobinu nebo aktivita leukocytárních esteráz přetrvává i několik hodin po uvolnění z buněk.
- Tab. 1 Orientační vyšetření močového sedimentu pomocí diagnostických proužků
Diagnostický proužek (reakční zóna) Ekvivalent při mikroskopickém vyšetření Krev (hemoglobin / erytrocyty) Erytrocyty, erytrocytové válce Leukocyty Leukocyty, leukocytové válce Bílkovina Válce hyalinní, voskové, granulární Dusitany Bakterie
Mikroskopické vyšetření močového sedimentu
Postup při mikroskopickém vyšetření
- Příprava vzorku moči
- K mikroskopickému vyšetření močového sedimentu je odebírán střední proud první nebo druhé ranní moči. Doporučována je druhá ranní moč, neboť v prvním ranním vzorku bývají buněčné elementy poškozené nebo rozpadlé. Také výrazné snížení osmolality moči a alkalické pH snižuje výskyt formovaných elementů v důsledku jejich lýzy.
- Pro vyšetření močového sedimentu je nezbytné zpracovávat čerstvou moč do 1 hodiny po odběru. Prodlužování intervalu mezi odběrem moči a vyšetřením močového sedimentu je doprovázeno rozpadem a zánikem buněk.
- Vzorek moči dobře promícháme a poté do zkumavky odměříme 5 ml nebo 10 ml moči. Centrifugujeme při 400 g po dobu 5 minut, nejlépe při 4 °C. Poté opatrně odsajeme 9 dílů supernatantu; to znamená, že sediment je 10× koncentrovaný. Pokud pracujeme s obarveným preparátem (viz níže), přidáme barvivo v množství, které odpovídá 10 % celkového objemu.
- Postup barvení
- 50 μl barvícího roztoku (alciánová modř a pyronin B v poměru 1:1) rozředíme v 0,5 ml močového sedimentu a jemně promícháme.
- Po 5 minutách přeneseme 13 μl obarveného sedimentu na podložní sklíčko a překryjeme krycím sklíčkem o rozměrech 18×18 mm. Lze použít i větší objem obarveného vzorku s odpovídající velikostí krycího sklíčka.
- Vzorek prohlížíme nejdříve orientačně při zvětšení 100–200×, kdy můžeme posoudit rovnoměrnost rozdělení elementů a všimnout si vzácně se vyskytujících částic jako jsou válce a epitelové buňky. Poté přistoupíme k počítání elementů při zvětšení 400× minimálně v 10 náhodně vybraných zorných polích. Po přepočtu na původní objem moči se výsledky udávají jako průměrný počet částic v 1 μl moči. Vyšší přesnosti počítání elementů se docílí použitím komůrky (Bürkerova či jiné komůrky).
Možnosti mikroskopického vyšetření
K mikroskopickému vyšetření močového sedimentu se používá mikroskopie v procházejícím světle a technika fázového kontrastu, ve speciálních případech i mikroskopie s polarizačním filtrem.
- Mikroskopie v procházejícím světle
- Umožňuje hrubou orientaci nebo vyhledávání patologických nálezů. Při použití světelné mikroskopie nebarvených preparátů mohou uniknout při hodnocení hyalinní válce a bakterie. V nebarvených preparátech je velmi obtížná přesná identifikace leukocytů, makrofágů a renálních tubulárních buněk. Pro spolehlivé určení morfologie močových elementů se doporučuje supravitální barvení, které zdůrazní některé buněčné detaily. Pod pojmem supravitální barvení rozumíme barvení mokrého nefixovaného preparátu, v němž některé buňky ještě přežívají. Je doporučováno Sternheimerovo barvení, využívající barevného kontrastu modré a červené pomocí alciánové modři a pyroninu B. Alciánová modř vzhledem k výrazné afinitě k mukopolysacharidům barví povrch buněk a elementů, pyronin B proniká dovnitř buněk a barví zejména cytoplazmu.
- Mikroskopie ve fázovém kontrastu
- Je vhodnou metodou pro rychlé vyhodnocování nebarvených preparátů. Používá se k podrobnějšímu posouzení sedimentu, zejména lepšímu rozpoznání leukocytů, válců a krystalů a diferenciaci erytrocytů, včetně morfologických změn membrán. Dokonalejší zobrazení detailů umožňuje zvýšení kontrastu, který se dosahuje posunem fáze světelné vlny části paprsků.
- Mikroskopie s polarizačním filtrem
- Je vhodná k lepší identifikaci krystalů a tukových tělísek.
Součásti močového sedimentu a jejich hodnocení
V močovém sedimentu posuzujeme orgánové součásti, zastoupené především buňkami, popř. válci, a neorgánové, mezi které řadíme krystaly. Dále si všímáme přítomnosti mikroorganismů a vyskytnout se mohou i různé artefakty. Hlavní součásti močového sedimentu jsou shrnuty v tabulce 2.
- Tab. 2 Přehled hlavních součástí močového sedimentu
Buněčné elementy krevní buňky erytrocyty leukocyty lymfocyty makrofágy epitelie renální tubulární buňky buňky přechodného epitelu dlaždicové epitelie nádorové buňky Válce bezbuněčné hyalinní granulované voskové tukové buněčné erytrocytové leukocytové epitelové bakteriální Mikroorganismy bakterie kvasinky trichomonády plísně Krystaly
Buněčné elementy
Leukocyty
- Nejčastěji jsou prokazovány polymorfonukleární granulocyty. Jsou to okrouhlé buňky (průměrná velikost 10 μm) s granulovanou cytoplazmou. Jádro je segmentované, ale často podléhá degenerativním změnám a je v tomto případě špatně odlišitelné od cytoplazmy. Někdy se špatně barví; pokud se obarví, je výrazně modré, zatímco cytoplazma bývá zbarvena do červena a červenohněda. Vzhled granulocytů ovlivňuje rovněž osmolalita moči. Často se shlukují. Nález je charakteristický pro infekci močových cest, pokud jsou současně přítomny i erytrocyty může jít o postižení glomerulů. Asi v 50 % současně s leukocyty nalézáme i bakterie. Eosinofily lze prokázat pouze při použití speciálního barvení. Falešně pozitivní nález může být způsoben kontaminací moči (vaginální sekret, nedodržení pokynů pro odběr moči – první proud).
- Výskyt lymfocytů v moči je spojen většinou s chronickými záněty ledvin, někdy s virovými infekcemi a dále s rejekcí ledviny po transplantaci. Lymfocyty mají homogenní jádro s tenkým okrajem cytoplazmy. Poměr jádra k cytoplazmě a hladká struktura cytoplazmy je nejlépe odliší od renálních tubulárních buněk.
- Někdy se můžeme setkat i s makrofágy. Jejich nález je poměrně častý u infekce močových cest.
- Referenční hodnoty:
- ≤ 10 leukocytů/μl moči,
- orientačně < 5 leukocytů/zorné pole.
Erytrocyty
- Přítomnost erytrocytů v moči je obvykle příznakem onemocnění ledvin či vývodných cest močových. Erytrocyty jsou menší než leukocyty. Jeví se jako bezjaderná diskoidní tělíska o průměrné velikosti asi 6 μm. V hyperosmolální moči, kde erytrocyty snadno ztrácejí intracelulární tekutinu, se snižuje jejich průměr a stávají se krepované až ostnité. Naopak v hypoosmolální moči tekutina do erytrocytů vstupuje, zvětšují se a mohou se rozpadnout. Při nízkém obsahu hemoglobinu jsou těžko rozpoznatelné a jeví se jako tzv. stíny.
- Ze vzhledu červených krvinek můžeme usuzovat na jejich původ. Při značném poškození glomerulární membrány je možný průnik nejen bílkovin, ale i erytrocytů. Při průchodu erytrocytu glomerulární membránou dochází k deformaci tvaru a změně struktury. Erytrocyty, které vykazují odchylky od diskoidního tvaru, se označují jako dysmorfní. Někdy mají tvar „pneumatiky“ (tzv. prsténčité čili anulární erytrocyty), jindy membrána erytrocytů vybíhá do měchýřkovitých výběžků, v tomto případě hovoříme o akantocytech. Zvýšený výskyt dysmorfních erytrocytů je typický pro postižení ledvinných glomerulů. Zastoupení dysmorfních erytrocytů ve více než 80 % svědčí o glomerulární hematurii a obvykle nalézáme současně i proteinurii. Pokud jsou ve více než 80 % zastoupeny izomorfní erytrocyty, jedná se o neglomerulární hematurii, kdy zdrojem erytrocytů je krvácení z močových cest nebo krvácení z prasklých cév při nádorech ledvin nebo při urolitiáze. Pro identifikaci dysmorfních erytrocytů je nutná mikroskopie ve fázovém kontrastu.
- Příčiny hematurie musí být vždy objasněny, zejména je třeba vyloučit nádorové onemocnění nebo závažnou glomerulopatii (glomerulonefritidu).
- Příčinou zvýšeného počtu erytrocytů v močovém sedimentu může být i extrémní fyzická námaha, užívání antikoangulancií nebo příměs menstruační krve.
- Referenční hodnoty:
- < 5 erytrocytů/μl moči,
- orientačně < 5 erytrocytů/zorné pole.
Epitelie
Pocházejí z epitelové výstelky renálních tubulů a vývodných cest močových.
- Renální tubulární buňky
- Jejich výskyt v močovém sedimentu je vždy patologickým nálezem a svědčí pro vážné poškození ledvin, zejména pro choroby postihující tubuly (akutní tubulární nekróza, akutní intersticiální nefritida). Jsou to relativně malé buňky (průměrná velikost 13 μm) jen o něco větší než leukocyty buď kulaté, nepravidelně polygonální, kubické nebo fasetované s hladkým, zpravidla excentricky uloženým (v barveném vzorku tmavomodrým) kulatým jádrem, bez jadérek. Vyznačují se granulovanou cytoplazmou, v barveném vzorku je červená. Zpravidla se vyskytují samostatně, někdy jsou ve shlucích nebo mohou tvořit válce.
- V nebarveném preparátu se těžko odlišují od buněk přechodného epitelu. Proto se někdy v laboratorní praxi užívá termín „malé kulaté epitelové buňky“. Mohou být zaměněny i za leukocyty.
- Buňky přechodného epitelu
- Pocházejí z povrchních nebo hlubších vrstev přechodného epitelu vystýlajícího vývodné močové cesty. Není možná jejich lokalizace do určité části urogenitálního traktu. Častějším nálezem jsou buňky z povrchových vrstev, které jsou kulaté nebo ovoidní s kulatým nebo ovoidním jádrem lokalizovaným centrálně nebo lehce excentricky s viditelným jadérkem a s cytoplazmou, která je většinou jemně granulovaná (méně než u tubulárních buněk), granulace bývá obvykle na periferii buňky, vzácně kolem jádra. Průměrná velikost je kolem 30 μm. Jejich nález svědčí obvykle o infekci dolních močových cest, zejména při současném výskytu leukocytů. Mohou se vyskytnout i v moči zdravých lidí.
- Buňky z hlubších vrstev jsou menší (průměrná velikost 17 μm), ovoidní a jejich tvar je mnohem variabilnější (tvar kyje, kladívek či buněk s ocásky). Častým nálezem jsou dvoujaderné buňky. Setkáváme se s nimi v moči pacientů s uroteliálními karcinomy či močovými konkrementy.
- Dlaždicové epitelie
- Jsou největší buňky v močovém sedimentu (průměrná velikost 55 μm), obdélníkovitého až polygonálního tvaru s malým jádrem a bohatou cytoplazmou. Pocházejí většinou z uretry, případně z vaginy a jejich množství závisí na kvalitě provedeného odběru vzorku moči. Nacházejí se obvykle v moči žen při špatném kontaminovaném odběru, nemají diagnostický význam.
Nádorové buňky
- Nádorové buňky se mohou uvolňovat do moči u nádorů ledvin, vývodných cest močových a přídatných orgánů (např. prostaty). Je pro ně typický nepravidelný tvar jádra, které je v poměru k cytoplazmě zpravidla zřetelně větší. Bez barvení je přítomnost nádorových buněk obtížně prokazatelná (tab. 3).
- Tab. 3 Základní morfologická charakteristika buněk močového sedimentu
| Buněčný typ | Jádro | Cytoplazma |
|---|---|---|
| Erytrocyt | bezjaderný element | diskoidní tělíska |
| Granulocyt | segmentované, vícelaločnaté, jasně modré, někdy se barví špatně | granulovaná, obvykle se barví červeně |
| Makrofág | často rozbitá modrá jádra, nehomogenní chromatin | granulární, obvykle obsahuje části erytrocytů či jiného fagocytovaného materiálu |
| Lymfocyt | velké, hladké jádro, vyplňující téměř celou buňku | tenký okraj cytoplazmy bez granulací |
| Dlaždicová buňka | degenerované, malé (polygonální) lokalizované uprostřed | nevýrazná bohatá |
| Buňky přechodného epitelu superficiální | oválné nebo kulaté, zpravidla uložené ve středu buňky, chromatin jemně granulovaný, příležitostně se vyskytuje jadérko | jemně granulovaná cytoplazma, granulace častěji na periférii buňky |
| Buňky přechodného epitelu hluboké | dobře definované, zřetelná jadérka | četné granule mohou být tmavě červené |
| Renální tubulární buňka | homogenní jasné, kulovité nebo oválné, zpravidla excentricky uložené | hruběji granulovaná hustá cytoplazma, často tmavě červená, uvnitř může obsahovat tukové částice |
Válce
Válce jsou útvary cylindrického tvaru, vznikající v distálních tubulech a sběrných kanálcích ledvin. Matrix je tvořena Tamm-Horsfallovým proteinem, který je produkován tubulárními epiteliálními buňkami, jejichž povrch chrání. Za určitých okolností, jako je nízké pH, vysoká osmolalita, vysoké koncentrace proteinů, může Tamm-Horsfallův protein precipitovat a vytvářet odlitky tubulů, které jsou uvolňovány do moči. Při mikroskopickém vyšetření jsou popisovány jako válce. Do matrix válce se během precipitace může zabudovat i další materiál, např. buněčné elementy (leukocyty, erytrocyty, renální buňky), pigmenty (hemoglobin, bilirubin), krystaly a plazmatické bílkoviny. Válce jsou jediné elementy, které jsou vždy renálního původu, nemohou pocházet z vývodných cest močových. Morfologie válců závisí na průměru tubulů, ve kterých se utvářejí. V případě, že tubulus, v němž válec vzniká, je rozšířen v důsledku atrofie nebo obstrukce, vytvářejí se široké válce, typické pro selhání ledvin.
Podle vzhledu se válce klasifikují na:
- bezbuněčné
- hyalinní,
- granulované,
- voskové,
- tukové;
- buněčné (plocha válce je z více než 1/3 pokryta buňkami)
- erytrocytové,
- leukocytové,
- epitelové,
- bakteriální.
Průkaz buněčných válců v močovém sedimentu je vždy známkou patologického procesu v ledvinách (tab. 4).
- Tab. 4 Přehled a diagnostický význam jednotlivých typů válců v močovém sedimentu'
| Označení válce | Charakteristika | Diagnostický význam |
|---|---|---|
| Hyalinní |
|
|
| Granulované |
|
|
| Voskové |
|
|
| Tukové válce a válce z tukových buněk |
|
|
| Epitelové |
|
|
| Erytrocytové |
|
|
| Leukocytové (granulocytové) |
|
|
| Bakteriální |
|
|
Mikroorganismy
- Za fyziologických okolností obsahuje moč bakterie v množství menším než 105/ml. Mají vzhled malých kokovitých nebo tyčinkovitých útvarů, které se od ostatních elementů liší.
- Přítomnost bakterií může být také známkou nesterilně odebrané moči, neboť bakterie se při delším stání vzorku rychle množí.
- Mají kruhovitý nebo oválný tvar s bičíky, vyznačují se rychlým nepravidelným pohybem, pokud jsou živé. Jejich častý nález je u současně probíhajícího zánětu pochvy.
- Jsou o něco menší než erytrocyty, oválné, ale různě velké. Nacházíme je ve skupinách a někdy se seskupují ve formě řetízků. Jsou častým nálezem u diabetiků, u nemocných léčených imunosupresivními preparáty a někdy i po podávání antibiotik.
Krystaly
Vyšetření krystalů je nutno provádět v ranní moči ihned po jejím odběru. Nález krystalů, které se v močovém sedimentu vyskytují poměrně často, nelze přeceňovat. Výskyt krystalů může být následkem přechodného přesycení moči, např. při příjmu potravy bohaté na uráty nebo oxaláty, a je signálem pro zvýšení příjmu tekutin. In vitro dochází k vytvoření krystalů při ochlazení vzorku moči nebo při změnách pH. Nález krystalů za těchto okolností je klinicky nevýznamný.
- Častý je nález krystalů kyseliny močové a amorfních urátů v kyselé moči a fosforečnanu amonno-hořečnatého v alkalické moči při infekci močových cest.
- Detekce krystalů je významná u pacientů s urolitiázou. Jejich průkaz může naznačit, o jaký druh konkrementů se jedná. Z nálezů krystalů v moči nelze však činit závěry, že v močových cestách je konkrement stejného chemického složení. Opakovaný průkaz krystalů má význam zejména při kontrole pacientů po odstranění konkrementu nebo u pacientů s recidivou urolitiázy.
- Identifikace šestibokých krystalů cystinu podpoří diagnostiku cystinurie.
- Nález krystalů fosforečnanu amonno-hořečnatého společně s vysokým pH moči ukazuje na pravděpodobnost struvitových konkrementů.
- Záplava krystalů šťavelanu vápenatého je charakteristickým nálezem u otravy ethylenglykolem, jinak jsou tyto krystaly častým nálezem zejména u osob s vyšším příjmem rostlinné stravy a nemají vztah k tvorbě konkrementů. Jiným příkladem jsou krystaly kyseliny močové u urátové nefropatie.
- Přítomnost krystalů leucinu a tyrosinu doprovází těžké onemocnění jater. Také některé léky mohou být vylučovány ve formě krystalů, zejména při předávkování, dehydrataci nebo hypoalbuminemii. Vliv má i pH moči v závislosti na povaze léku.
- Cholesterolové krystaly jsou známkou těžkého poškození glomerulární membrány (tab. 5).
- Tab. 5 Vybrané krystaly v močovém sedimentu
| Druh krystalu | Typický tvar | pH moči | Klinický význam | ||
| Kyselé | Alkalické | Proměnlivé | |||
| Močany (uráty) | amorfní | + |
| ||
| Kyselina močová | různé tvary, "soudky", "rosety" | + |
| ||
| Močan amonný | kuličky, „trnová jablka“ | + |
| ||
| Uhličitan vápenatý | kuličky uspořádané do tvaru činky | + |
| ||
| Fosforečnan amonno-hořečnatý (triple fosfát) | tvar „víka od rakve“ | + |
| ||
| Šťavelan vápenatý | „obálky“ (dihydrát), „piškoty“ – (monohydrát) | + |
| ||
| Cholesterol | ploché destičky s odlomeným rohem | + |
| ||
| Cystin | šestiboké hranoly | + |
| ||
| Tyrosin | tenké jehličky ve snopečcích nebo v rozetách | + |
| ||
| Leucin | olejovité kuličky | + |
| ||
Lipidy
- Lipidy mohou pronikat do moči porušenou glomerulární membránou ve formě plazmatických lipoproteinů. Lipoproteinové částice jsou větší než samotné bílkoviny, a proto je lipidurie spojena s těžkou proteinurii a signalizuje závažné poškození ledvin.
- Lipidy se vyskytují ve formě volných kapének izolovaných nebo ve shlucích; v tomto případě jejich přítomnost může být vyvolána kontaminací, např. čípky. Intracelulárně lokalizované tukové inkluse jsou známkou degenerativních změn buněk. Další formou jsou cholesterolové krystaly nebo tukové válce.
Další nálezy
- V močovém sedimentu můžeme dále zaznamenat pohyblivé spermie s dlouhým tenkým bičíkem, hlenová a fibrinová vlákna a různé kontaminující útvary, jako jsou vlákna toaletního papíru nebo různých textilií.
Kvantitativní vyšetření močového sedimentu podle Hamburgera
V indikovaných případech lze provádět kvantitativní vyšetření močového sedimentu podle Hamburgera, pomocí něhož se sleduje rychlost, s jakou jsou do moči vylučovány erytrocyty, leukocyty a válce. Pacient sbírá moč 3 hodiny. V krajním případě se toleruje odchylka ±30 minut, kterou je třeba vzít v úvahu při výpočtu. Po skončení sběru se do 1 hodiny do laboratoře dodá celý objem nasbírané moči. Zároveň je nezbytné udat s přesností na minuty dobu sběru. V sedimentu se hodnotí počet erytrocytů, leukocytů a válců v 5 velkých čtvercích Bürkerovy komůrky.
- Referenční hodnoty
- Erytrocyty do 2000/min, tj. 33 Er/s.
- Leukocyty do 4000/min, tj. 67 Leu/s.
- Válce do 60–70/min, tj. 1 válec/s.
Automatická analýza močového sedimentu
V současnosti jsou dostupné přístroje pro automatizované vyšetření močového sedimentu. Pracují na principu průtokové cytometrie nebo digitálního snímání částic.
Průtoková cytometrie
Průtoková cytometrie je laboratorní metodou, která umožňuje současné měření řady parametrů u velkého množství částic. Vedle hematologie se postupně začíná rozšiřovat její uplatnění při vyšetření močového sedimentu, které až dosud významně zatěžovalo laboratoře a kromě toho bylo zatíženo subjektivní chybou. Při průtokové cytometrii jsou částice označovány různými fluorofory a poté je buněčná suspenze hnána úzkou kapilárou. Při průchodu kapilárou se částice setkávají s paprskem světla, obvykle z laseru, který vybudí fluorescenci fluoroforů. Světlo laseru je buňkou rozptylováno. Nejčastěji měřenými parametry jsou rozptyl světla pod malým úhlem, který je přímo úměrný velikosti buněk – tzv. forward scatter, rozptyl světla do velkého úhlu tzv. side scatter, který poskytuje informaci o vnitřní struktuře částic, a fluorescence různé vlnové délky. Průtokový cytometr je plně automatizovaný analyzátor pro analýzu a identifikaci buněk a dalších elementů nativních močových vzorků.
- Postup analýzy
- Při vyšetření močového sedimentu průtokovou cytometrií je moč po promíchání nasáta (0,8 ml), naředěna a je změřena vodivost.
- Následuje automatické obarvení močových elementů dvěma odlišnými fluorescenčními barvivy. Fenanthridinové barvivo barví nukleové kyseliny (oranžová fluorescence). Druhé používané barvivo – karbocyanin je určen k nabarvení negativně nabitých buněčných membrán, jaderných membrán a mitochondrií (zelená fluorescence).
- Obarvené částice procházejí kapilárou a jsou ozářeny laserovým paprskem, který je buňkou jednak rozptýlen a jednak je vybuzena fluorescence fluoroforů. Současně se měří elektrická vodivost částic v kapiláře. Identifikace a počítání elementů je umožněno hodnocením fluorescence obou barviv společně s měřením rozptylu záření emitovaným laserem a naměřenou vodivostí.
Pomocí průtokového cytometru lze diagnostikovat všechny buněčné elementy – erytrocyty, leukocyty, bakterie a epitelové buňky. Kromě toho je schopen diferencovat některé klinicky významné modifikace jako jsou izomorfní a dysmorfní erytrocyty. Poskytuje informaci o přítomnosti patologických válců, které je však zapotřebí dále mikroskopicky vyšetřit. Prokazuje rovněž krystalické struktury, ale nerozliší jednotlivé typy krystalů, i v tomto případě je zapotřebí mikroskopické upřesnění. Průtokový cytometr není schopen diferencovat trichomonády. Počet erytrocytů, leukocytů, bakterií, plochých epitelií a válců je udáván v počtu elementů/μl. Pro zvýšení správnosti analýzy močového sedimentu je možno automaticky porovnat výsledky chemické analýzy pomocí diagnostických proužků, která je vyhodnocována reflexním fotometrem, a analýzy průtokovou cytometrií, tzv. cross-check. Shoda průtokové cytometrie s mikroskopií se pohybuje v rozmezí 80–90 %, shoda s diagnostickými proužky v 72–96 %. Průtoková cytometrie výrazně snižuje nutnost mikroskopických analýz, zlepšuje přesnost měření a usnadňuje standardizaci výsledků.
Digitální snímání částic
Při tomto způsobu automatické analýzy močového sedimentu je vzorek necentrifugované moči vháněn do planární kyvety. Částice přítomné v moči jsou mnohonásobně snímány pomocí digitální kamery a jejich snímky jsou porovnávány na základě jejich velikosti, tvaru a struktury s databází, která je součástí software přístroje.
Video k automatické analýze moči můžete shlédnout zde.
Referenční hodnoty vyšetření moči
- Chemické vyšetření
- pH 5–7.
- Relativní hustota 1,016–1,022.
- Bílkovina do 0,3 g/l.
- Glukosa negativní.
- Ketolátky negativní.
- Bilirubin negativní.
- Urobilinogen 3,2–16 μmol/l.
- Krev do 5/μl.
- Leukocyty do 10/μl.
- Dusitany negativní.
- Sediment (kvantitativně)
- Erytrocyty < 33/s.
- Leukocyty < 67/s.
- Válce < 1/s, jen hyalinní.
Výsledky chemického vyšetření moči a močového sedimentu při infekci močových cest
Při podezření na infekci močových cest mimo jiné vyšetřujeme moč chemicky a dále hodnotíme močový sediment. V indikovaných případech využíváme i kultivační vyšetření moči s průkazem citlivosti k antibiotikům.
Chemické vyšetření moči
Při chemickém vyšetření moči můžeme při infekcích močových cest nalézt řadu odchylek:
- Alkaliurie
Některé bakterie (např. Pseudomonas, Klebsiella[4]) rozkládají močovinu pomocí enzymu ureázy na amoniak. Tím dochází k alkalizaci moče. Na infekci močových cest bychom proto měli myslet vždy, je-li pH moči vyšší než 6,5. Kyselejší moč ovšem močovou infekci nevylučuje.
- Jiné příčiny alkalické moči jsou vzácnější. Vyšší pH moči mívají osoby se stravou bohatou na rostlinné součásti.
- Nitrity
Především gramnegativní bakterie (hlavně E. coli, Proteus, Klebsiella, Aerobacter) mohou redukovat dusičnany na dusitany. Průkaz dusitanů je tak nepřímou známkou bakteriurie. Tento test je velmi specifický, jeho citlivost se však pohybuje jen kolem 50 % [5].
- Hematurie
Je prokazatelná při většině močových infekcí. Pozitivitu chemického vyšetření moči na krev může způsobit i přítomnost peroxidáz při bakteriurii. Test je bohužel málo specifický.
- Leukocyturie
Také doprovází velkou část infekcí močových cest. Citlivější než chemické vyšetření moči bývá kvantitativní vyšetření močového sedimentu.
- Proteinurie
Množství bílkoviny v moči při infekcích močových cest kolísá od koncentrací, které nejsou základními technikami stanovitelné, až po hodnoty kolem 2 g/l.
- Další nálezy v chemickém vyšetření moči
Při infekcích močových cest bývají často falešně pozitivní stanovení bilirubinu, urobilinogenu a ketolátek.
Z uvedeného vyplývá, že výsledek chemického vyšetření moči může být při infekci močových cest velmi bohatý. Na druhou stranu se ale setkáme i s bakteriuriemi se zcela normálním chemickým nálezem. Jakákoliv kombinace výsledků mezi těmito dvěma extrémy je proto s diagnózou infekce močových cest kompatibilní. Platí ovšem:
- Jsou-li pozitivní nitrity, je močová infekce téměř jistá (specifita > 95 %). Poměrně často ale při močové infekci nitrity zůstávají negativní (citlivost kolem 50 %).
- U 98 % močových infekcí je pozitivní alespoň jeden z parametrů hematurie, leukocyturie, nitrity, proteinurie [6]. S výjimkou nitritů je ale nález často vyvolaný jinou příčinou a infekci močových cest je proto nutné potvrdit dalším vyšetřením (mikroskopicky a kultivačně).
Vyšetření sedimentu
V močovém sedimentu při infekcích močových cest nalézáme obvykle vyšší počty erytrocytů a leukocytů; v těchto parametrech bývá vyšetření sedimentu citlivější než vyšetření chemické. Dále bývají vyšší počty epitelových buněk odpovídajících místu zánětu a pochopitelně nalézáme větší množství bakterií.
Odkazy
Související články
Reference
- ↑ HURYCH, Jakub. Lékařská mikrobiologie : repetitorium. 3. vydání. Praha : Triton, 2021. s. 547. ISBN 978-80-7553-976-2.
- ↑ a b HOHENBERGER, E.F. a H KIMLING. Compendium urinanalysis. Urinanalysis with test strip [online] . 1. vydání. Mannheim : Roche Diagnostics, 2008. 105 s. Dostupné také z <http://www.diavant.info/diavant/servlet/MDBOutput?fileId=1392>.
- ↑ PLIVA-Lachema Diagnostika. PHAN® diagnostické proužky k vyšetření moče [online]. Poslední revize 2009-12-04, [cit. 2010-03-21]. <https://www.erbalachema.com/cz/>.
- ↑ PECKOVÁ, Marie. Základní soubory laboratorních vyšetření : Chemické, mikroskopické a bakteriologické vyšetření moče [online]. ©2011. [cit. 2014-05-27]. <http://www.propedeutika.cz/met_lab_moc.html>.
- ↑ FOX, Gary N. Sensitivity and specificity of urinary nitrite for UTIs. Am Fam Physician [online]. 2005, vol. 72, no. 11, s. 2180; author reply 2180, 2182, dostupné také z <https://www.ncbi.nlm.nih.gov/pubmed/16342841>. ISSN 0002-838X.
- ↑ PATEL, H D, S A LIVSEY a R A SWANN, et al. Can urine dipstick testing for urinary tract infection at point of care reduce laboratory workload?. J Clin Pathol [online]. 2005, vol. 58, no. 9, s. 951-4, dostupné také z <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1770822/?tool=pubmed>. ISSN 0021-9746.







![\mathrm{H}_2\mathrm{O}_2 + \mathrm{H}_2\mathrm{A}\ \xrightarrow[\mathrm{nebo\ hemoglobin\ a\ jin\acute{e}\ l\acute{a}tky}]{\mathrm{peroxid\acute{a}zy}}\ 2\ \mathrm{H}_2\mathrm{O} + \mathrm{A}](https://wikimedia.org/api/rest_v1/media/math/render/svg/23377fd4d265df004d50c7657f43bcbbe4cdc8ff)